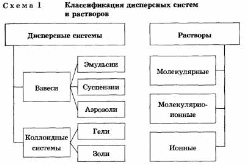
У природі найчастіше зустрічаються суміші різних речовин. Суміші різних речовин в різних агрегатних станах можуть утворювати гетерогенні і гомогенні системи. Такі системи ми будемо називати дисперсними.
Дисперсної називається система, що складається з двох або більше речовин, причому одне з них у вигляді дуже маленьких частинок рівномірно розподілено в обсязі іншого.
Речовина розпадається на іони, молекули, атоми, значить "дробиться" на найдрібніші частинки. "Дроблення"> диспергування, тобто речовини диспергируют до різних розмірів частинок видимих і невидимих.
Речовина, яка присутня в меншій кількості, диспергирует і розподілено в обсязі іншого, називають дисперсною фазою. Вона може складатися з декількох речовин.
Речовина, присутня в більшій кількості, в обсязі якого розподілена дисперсна фаза, називають дисперсною середовищем. Між нею і частинками дисперсної фази існує поверхню розділу, тому дисперсні системи називаються гетерогенними (неоднорідними).
І дисперсне середовище, і дисперсну фазу можуть представляти речовини, що знаходяться в різних агрегатних станах - твердому, рідкому і газоподібному.
13Вопрос. Емульсії. Суспензії. колоїдні розчини
Емульсія являє собою дисперсію мікроскопічних часток однієї рідини в іншій. Емульсії можуть бути утворені двома будь-якими не змішуються рідинами. У більшості випадків однією з фаз емульсій є вода. Емульсії типу «масло у воді» (М / В) це емульсії, в яких безперервною фазою є вода, а дисперсною фазою - нерозчинна у воді «масляниста» рідина. Емульсії типу «вода в маслі» (В / М) це емульсії, в яких безперервною фазою є масло, а дисперсною фазою - вода. Емульсії можуть мати більше двох фаз. У таких емульсіях дисперговані частинки самі містять ще менші частинки третьої фази (як правило, це та ж сама рідина, що і в безперервній фазі). Емульсія, яка утворюється при змішуванні масла і води, швидко розпадається при зупинці цього процесу. Для стабілізації системи в емульсію вводять третій компонент (емульгатор), який запобігає або уповільнює поділ фаз. Бітумні емульсії, зазвичай, представляють собою емульсії типу М / В. Однак інвертовані (зворотні) емульсії, отримані на розріджених бітумах, також мають свою спеціальну область застосування. Є свідчення того, що з бітуму можуть бути сформовані багатофазні емульсії типу В / М / В. Емульсії, які містять від 40-ка до 80-ти% бітуму, являють собою рідину коричневого кольору. Консистенція цієї рідини - «від молока до густих вершків». Розмір частинок (в діаметрі) становить зазвичай 0,1 - 20 мікрон.
Суспензія - суміш речовин, де тверда речовина розподілено у вигляді найдрібніших частинок в рідкому речовині в підвішеному стані. Суспензія - це грубодисперсна система з твердої дисперсної фазою і рідким дисперсійним середовищем. Зазвичай частинки дисперсної фази настільки великі (понад 10 мкм), що осідають під дією сили тяжіння (седіментіруют). Суспензії, в яких седиментація йде дуже повільно через малу різницю в щільності дисперсної фази і дисперсійного середовища, іноді називають металевий порошок. У концентрованих суспензіях легко виникають дисперсні структури. Типові суспензії - пульпи, бурові промивні рідини, цементні розчини, емалеві фарби. Широко використовуються у виробництві кераміки.
Колоїдні розчини - це високодисперсні двофазні системи, що складаються з дисперсійного середовища і дисперсної фази, причому лінійні розміри частинок останньої лежать в межах від 1 до 100 нм. Як видно, колоїдні розчини за розмірами частинок є проміжними між істинними розчинами і суспензіями, і емульсіями. Колоїдні частинки звичайно складаються з великого числа молекул або іонів. Колоїдні розчини інакше називають золями. Їх отримують дисперсійними і конденсаційними методами. Диспергирование найчастіше роблять за допомогою особливих «колоїдних млинів». При конденсаційному методі колоїдні частинки утворюються за рахунок об'єднання атомів або молекул в агрегати. При протіканні багатьох хімічних реакцій відбувається конденсація і утворюються високодисперсні системи. На відміну від істинних розчинів для золів характерний ефект Тін Даля, т. Е. Розсіювання світла колоїдними частинками. При пропущенні через золь пучка світла з'являється світлий конус, видимий в затемненому приміщенні. Так можна розпізнати, є даний розчин колоїдних або істинним. Одним з важливих властивостей золів є те, що їх частки мають електричні заряди одного знака. Завдяки цьому вони не з'єднуються в більші частки і не осідають. При цьому частки одних золів, наприклад, металів, сульфідів, кремнієвої та олов'яної кислот, мають негативний заряд, інших, наприклад, гідроксидів, оксидів металів, - позитивний заряд. Виникнення заряду пояснюється адсорбцією колоїдними частинками іонів з розчину. Для осадження золю необхідно, щоб його частинки з'єдналися в більші агрегати. З'єднання часток в більш великі агрегати називається коагуляцією, а осадження їх під впливом сили тяжіння - седиментацією. Зазвичай коагуляція відбувається при додаванні до золю: 1) електроліту, 2) іншого золю, частки якого мають протилежний заряд, і 3) при нагріванні.