Види корозії заліза. суцільна, місцева, межкристаллитная, підводний, підземна, атмосферна, біокоррозія, корозійна втома.
Корозійна стійкість заліза.
Найбільш відомими видами корозії заліза і його сплавів є суцільна, місцева, межкристаллитная, підводний, підземна, атмосферна, біокоррозія, корозійна втома і ін.
Суцільна корозія заліза. У розведеної H2 SO4 цей процес протікає за рівнянням
Fe = Fe 2+ + 2 # 275 ;, 2Н + + 2 # 275; = Н2
У лужних розчинах залізо кородує по реакції
У присутності кисню в нейтральних або близьких до них розчинах руйнування заліза протікає по реакції
При цьому утворюється Fe 3+. а при нестачі кисню виходить змішаний оксид ферроферріт (Fe3 O4 x Н2 O). Вода (1 л), насичена повітрям, може викликати корозію на поверхні (1 см 2) заліза на глибину => 0,022 мм. Якщо поряд з виділенням водню відбувається киснева деполяризація, то загальна корозія посилюється (корозія заліза у водопровідній воді, яка містить СО2. Небезпечна тільки в присутності кисню).
Місцева або наскрізна корозія заліза призводить до появи кратероподібної заглиблень і наскрізних отворів при наявності окисної середовища і речовини, здатного роз'їдати окисні плівки (іони хлору, брому, йоду з концентрацією> 3 * 10 -4 г - іон / л).
Стали, леговані кремнієм, молібденом і міддю, мають менше наскрізних виразок, ніж нелегіровані. Так, у аустенітних хромонікелевих сталей в 4% -ому розчині NaCl (90 ° С) найбільша глибина виразок досягається при рН = 5 ÷ 7, а з введенням NaOH знижується від 0,4 до 0,1 г / (м 2 • сут. ), а їх число зменшується від 14 до 2.
Межкристаллитная корозія заліза призводить до руйнування металу (сплаву) по межах зерен і до відриву останніх від загальної маси металу (особливо в розчинах хлоридів). Різновидом цієї корозії є ниткоподібна корозія (поява вузьких розрізів поблизу зварних швів, легованих ніобієм або титаном). Для запобігання корозії вуглець в сталях необхідно пов'язувати в карбіди.
До міжкристалітної корозії заліза схильні аустенітні сталі (при вмісті Ni більше 45% вони стійки). Марганець і молібден збільшують швидкість корозії, а бор (навіть
0,4%) зменшує її. Межкристаллитная корозія практично можлива в сірчаної кислоти при потенціалах від 0 до + 0,3 У і має максимум при + 0,15 В. Вона викликана збіднінням гранул зерен хромом. Тому стали, схильні до міжкристалітної корозії, можна експлуатувати, якщо їх стаціонарний потенціал лежить в області стійкого пасивного стану.
Графитизация чавуну не змінює форми деталей і з'являється під шарами іржі. При цьому металева зв'язок чавуну в уражених ділянках зникає і залишається тільки решітка графітових або цементітових прожилок, занурених у чорно-коричневі продукти корозії губчастої структури. Така корозія відбувається під дією сольових розчинів або слабких кислот, а також кислих грунтів.
Підземна корозія заліза. На рівні грунтових вод і при низькому значенні рН в грунті відбувається роз'їдання заліза. Чим вище рН грунту, тим вище його електроопір і тим слабкіше корозія. Корозія сталевих арматур в бетоні носить електрохімічний характер. Утворені пори і тріщини в бетоні заповнює вода, насичена гидроокисью кальцію з бетону. При цьому корозія арматури посилюється за рахунок неоднакового доступу атмосферного кисню до різних ділянок її поверхні, а також присутності хлоридів в повітрі і вологи.
Прокатна окалина, що має катодні функції, прискорює корозію. Найкращим захистом сталевої арматури в бетоні від корозії є цинкове покриття з хроматних пасивацією. Вуглецеві сталі в контакті з міддю корродируют зі швидкістю 0,43 - 1,52 мм / рік, з нікелем - 0,05 - 0,15 мм / рік.
Атмосферна корозія заліза. Механізм корозії вуглецевих і низьколегованих сталей спочатку характеризується наступними реакціями:
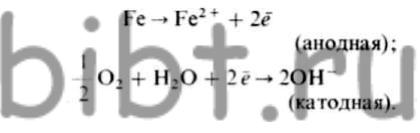
Якщо середовище, що містить нони Fe 2+, є лужний, то гідроксіліони, утворені за катодного реакції, потрапляючи на анодний ділянку, у вигляді вихідного продукту дають білу гідроокис:
У розчинах, які перебувають в повітряній атмосфері, Fe (OH) 2 легко окислюється до FeO (OH) або Fe3 O4 в залежності від рН розчину. У сільнощелочних розчинах утворюється 4Fe (OH) 2 + О2 -> 4FeO (OH) + 2Н2 O, в слаболужних 6Fe (OH) 2 + O2 -> 2Fe3 O4 + 6Н2 O. Коли водний розчин на поверхні металу нейтральний або має слабокислу реакцію, утворюються тільки гідроксильних-кисневі комплекси Fe (II). В атмосфері промислових районів, що містить сірчистий газ, на поверхні металу утворюється іржа зеленого кольору (Fe-II), яка потім окислюється, перетворюючись у чорний оксид Fe3 O4.
Погружная корозія заліза. За концентрації солей океанська вода еквівалентна
3,5% -ному розчину NaCl, а її рН коливається в межах 8,1 -8,3. Швидкість корозії вуглецевих сталей в ній
У водоохолоджуваних системах корозія заліза протікає з катодним відновленням розчиненого кисню. Анодами служать ділянки з обмеженим доступом O2 (продукти корозії, різні захисні покриття і т. Д.). Корозія відбувається з утворенням виразок і призводить до наскрізним руйнувань металу. Швидкість корозії стали контролюють по рН води. При високих швидкостях руху води відбуваються корозія при терті і кавітація. У першому випадку на стали виникають підковоподібні пошкодження (в теплообмінниках і інших апаратах). Кавітація приводить до локальних руйнувань внаслідок ударів в результаті різкого заповнення пустот, що утворюються у воді в зонах низького тиску. В таких умовах біхромати і нітрати підвищують потенціали заліза і переводять його в пасивний стан.
Петро Степанович Мельников. Довідник по гальванопокриття в машинобудуванні. Тисяча дев'ятсот сімдесят дев'ять.