Рівняння реакцій відносини металів:
- а) до простих речовин: кисню, водню, галогенів, сірки, азоту, вуглецю;
- б) до складних речовин: води, кислот, лугів, солей.
- До металів належать s-елементи I і II груп, все s-елементи, р-елементи III групи (крім бору), а також олово і свинець (IV група), вісмут (V група) і полоній (VI група). Метали в більшості своїй мають на зовнішньому енергетичному рівні 1-3 електрона. У атомів d-елементів всередині періодів зліва направо відбувається заповнення d-підрівнів предвнешнего шару.
- Хімічні властивості металів обумовлені характерною будовою їх зовнішніх електронних оболонок.
В межах періоду зі збільшенням заряду ядра радіуси атомів при однаковому числі електронних оболонок зменшуються. Найбільшими радіусами мають атоми лужних металів. Чим менше радіус атома, тим більше енергія іонізації, а чим більше радіус атома, тим менше енергія іонізації. Так як атоми металів мають найбільші радіусами атомів, то для них характерні в основному низькі значення енергії іонізації і спорідненості до електрона. Вільні метали проявляють виключно відновні властивості.
3) Метали утворюють оксиди, наприклад:
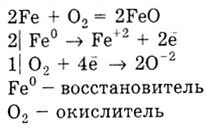
З воднем реагують тільки лужні і лужноземельні метали, утворюючи гідриди:
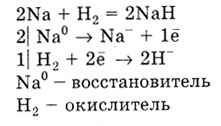
Метали реагують з галогенами, утворюючи галогеніди, з сірою - сульфіди, з азотом - нітрид, з вуглецем - карбіди.


Зі збільшенням алгебраїчного значення стандартного електродного потенціалу металу Е 0 в ряді напруг здатність металу реагувати з водою зменшується. Так, залізо реагує з водою тільки при дуже високій температурі:
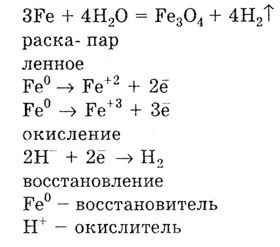
Метали з позитивним значенням стандартного електродного потенціалу, тобто стоять після водню в ряду напруг, не реагують з водою.
Характерні реакції металів з кислотами. Метали з від'ємним значенням Е 0 витісняють водень з розчинів НСl, H 2 S0 4. H 3 P0 4 і т. Д.
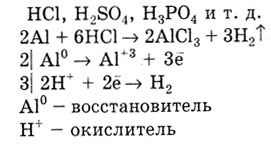
Метал з меншим значенням Е 0 витісняє метал з великим значенням Е 0 з розчинів солей:
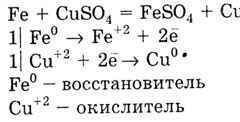
Найважливіші сполуки кальцію, одержувані в промисловості, їх хімічні властивості та способи одержання.
а) реагує з водою з виділенням великої кількості теплоти:
СаО + Н 2 0 = Са (ОН) 2 (гашене вапно).
б) реагує з кислотами, утворюючи сіль і воду:
СаО + 2Н + = Са 2+ + Н 2 О
в) реагує з кислотними оксидами з утворенням солі:
Гідроксид кальцію Са (ОН) 2 застосовується в вигляді гашеного вапна, вапняного молока і вапняної води.
Вапняне молоко - це суспензія, утворена при змішуванні надлишку гашеного вапна з водою.
Вапняна вода - прозорий розчин, отриманий при фільтруванні вапняного молока. Використовується в лабораторії для виявлення оксиду вуглецю (IV).
Са (ОН) 2 + СО 2 = СаСО 3 + Н 2 О
При тривалому пропущенні оксиду вуглецю (IV) paствор стає прозорим, так як утворюється кисла сіль, розчинна у воді:
Якщо отриманий прозорий розчин гідрокарбонату кальцію нагріти, то знову відбувається помутніння, так як випадає осад СаС0 3.