Завдання з використанням закону дії мас
У скільки разів зміниться швидкість прямої хімічної реакції, що протікає в гомогенної системі: 2NO + Br2 = 2NOBr2
при: а) збільшенні концентрації NO в два рази
б) зменшення концентрації Br2 в три рази
Т. к. Сказано, що система гомогенна, то всі речовини знаходяться в газовій фазі і їх концентрації входять в формулу закону дії мас. Запишемо вираз закону для цієї реакції: 1 = k [NO] 2 [Br2]
а) При збільшенні концентрації NO в три рази формула закону дії мас буде виглядати наступним чином: 2 = k [2NO] 2 [Br2] = 4k [NO] 2 [Br2] (винесли 2 з-під знака концентрації і звели її в квадрат). Таким чином 2 / 1 = 4k [NO] 2 [Br2] / k [NO] 2 [Br2] = 4. Отже швидкість прямої реакції збільшиться в 4 раз.
б) При зменшенні концентрації Br2 в три рази формула закону дії мас буде виглядати наступним чином: 2 = k [NO] 2 [
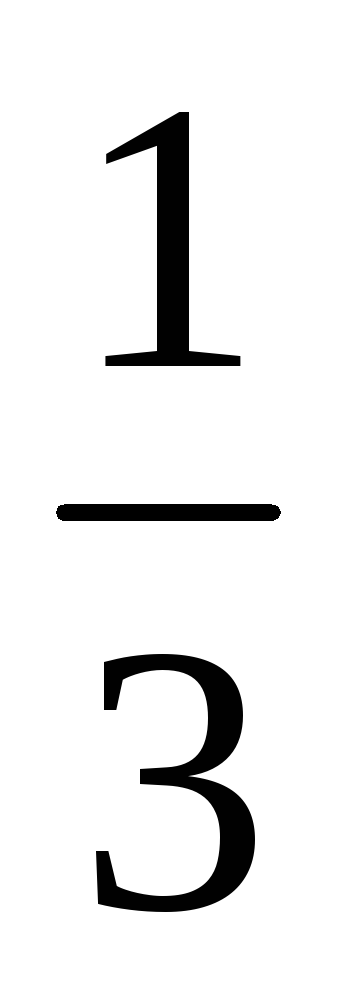
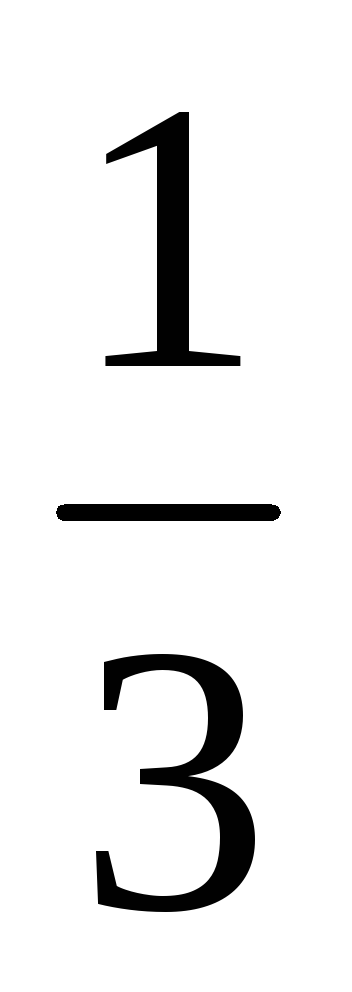
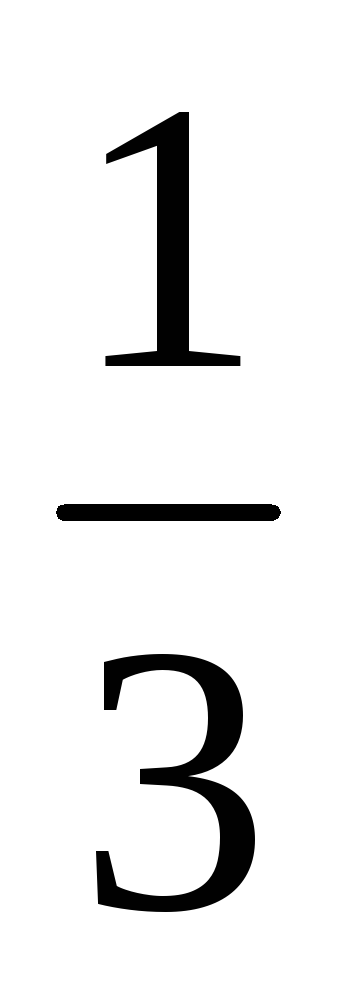
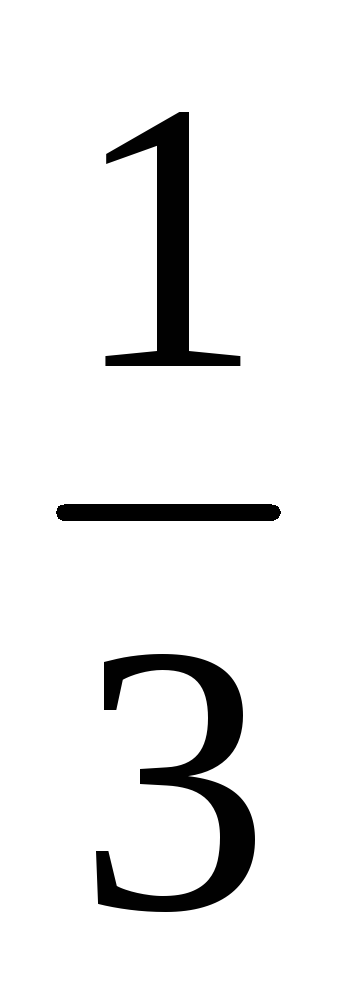
У скільки разів зміниться швидкість прямої хімічної реакції, що протікає в системі: 3А (г) + В (г) = 2С (г)
при: а) збільшенні обсягу в п'ять разів
б) збільшенні тиску в два рази
Т. к. Все речовини знаходяться в газоподібному стані, то їх концентрації входять в формулу закону дії мас.
Запишемо вираз закону для цієї реакції: 1 = k [А] 3 [B]
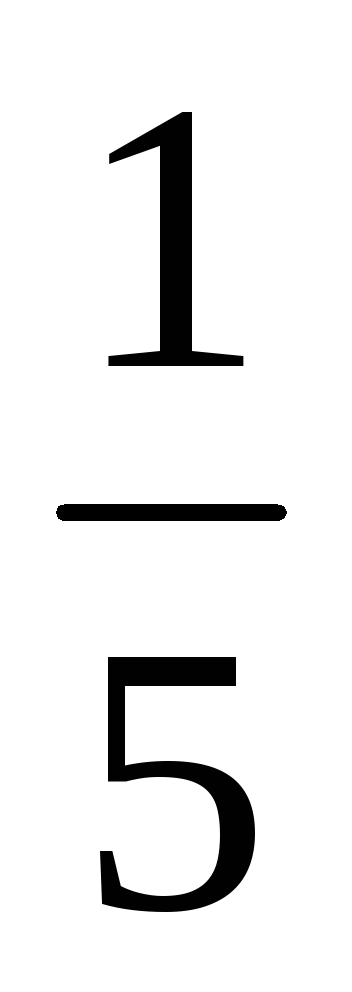
а) При збільшенні обсягу (або при зменшенні тиску) в n-е кількість разів концентрації реагуючих газоподібних речовин зменшуються в таку ж кількість разів, т. е. при збільшенні обсягу в п'ять разів концентрації А і В зменшуються в п'ять разів. Звідси 2 = k [
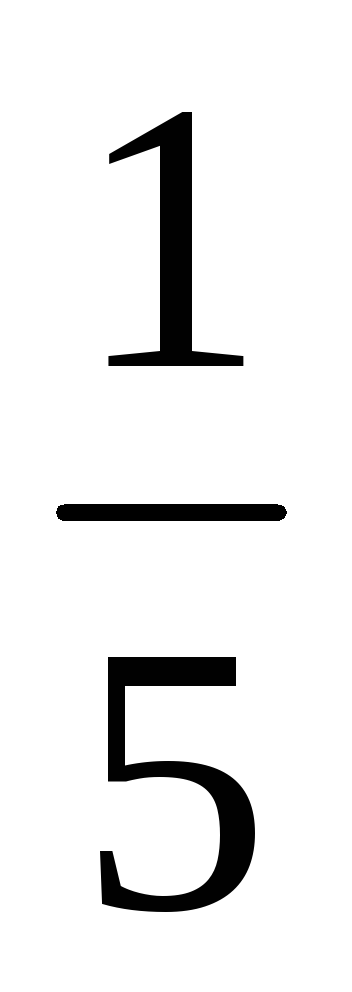
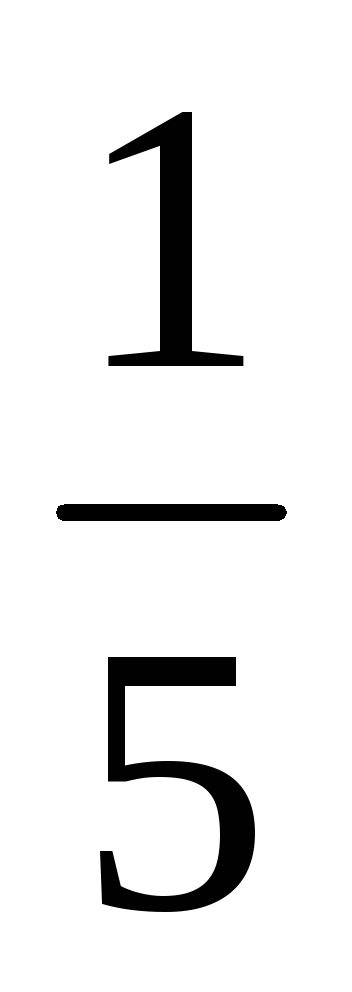
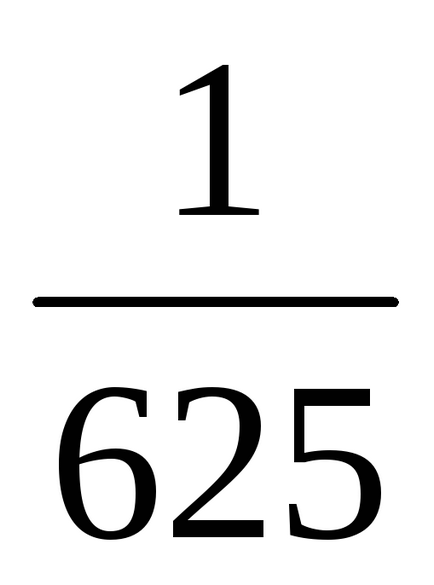
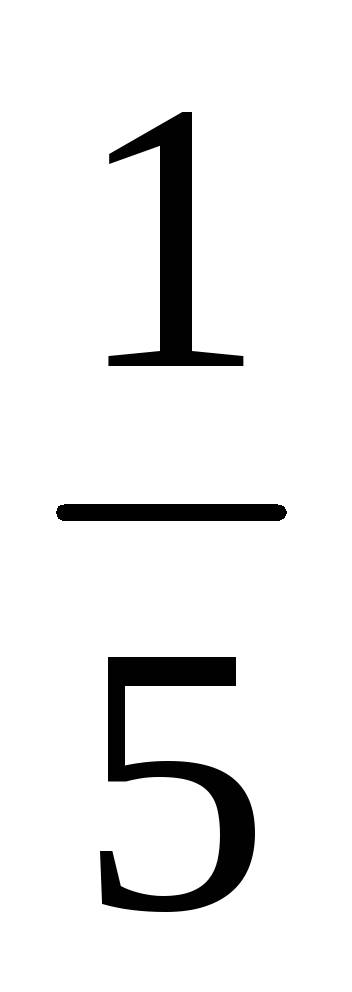
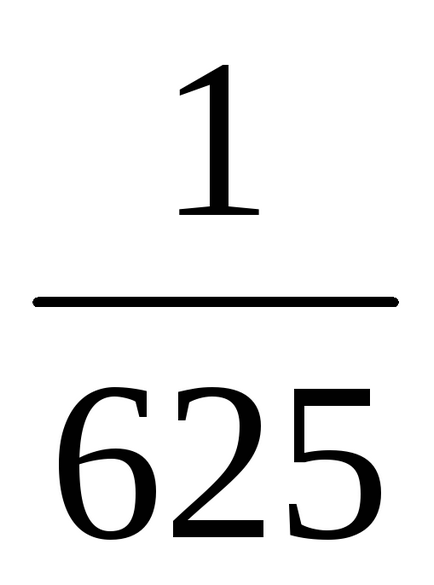
б) При збільшенні тиску (або зменшенні обсягу) в n-е кількість разів концентрації реагуючих газоподібних речовин збільшуються в таку ж кількість разів, т. е. при збільшенні тиску в два рази концентрації А і В збільшуються в два рази. Звідси 2 = k [2А] 3 [2B] = 16k [А] 3 [B]. Таким чином 2 / 1 = = 16k [А] 3 [B] / k [А] 3 [B] = 16. Отже швидкість прямої реакції збільшиться в 16 разів.
Як позначиться зменшення обсягу в чотири рази на швидкості наступних реакцій:
а) Так в даній системі одне з речовин (С) знаходиться в кристалічному стані, то його концентрація не входитиме в формулу закону дії мас. Отже 1 = k [О2]. При зменшенні обсягу в чотири рази концентрація О2 збільшується в чотири рази і 2 = k [4О2] = 4 k [О2]. Звідси 2 / 1 = = 4k [О2] ./ k [О2]. = 4 і швидкість прямої реакції збільшиться в 4 рази.
б) Оскільки серед вихідних речовин є тільки одна речовина, причому в кристалічному стані, то зміна обсягу не впливатиме на швидкість прямої реакції і вона не зміниться. __________________________________________________________________________
РАДА: звертайте увагу на те, в якому агрегатному стані знаходиться речовина в реакції і пам'ятайте, що концентрації речовин в кристалічному стані не враховуються.