Електроліз розчину NaCl - найбільш простий і економічний метод одночасного отримання трьох найважливіших хімічних продуктів - хлору, водню і гідроксиду натрію з використанням дешевого і доступного природної сировини. Це саме великомасштабне електрохімічне виробництво. Сумарна реакція в електролізері може бути виражена рівнянням
Хлор застосовують у великих масштабах як сировину для виробництва хлорорганічних розчинників і пластмас, синтетичних каучуків, хімічних волокон, отрутохімікатів. У металургії хлор застосовується для хлоруючого випалу руд, в текстильній і целюлозно-паперової промисловості - для очищення і відбілювання целюлози, паперової маси і тканин. Великі кількості хлору йдуть на очищення і стерилізацію стічних вод і питної води.
Гідроксид натрію використовується у виробництві багатьох хімічних продуктів, перш за все в промисловому органічному синтезі, в целюлозно-паперовому виробництві, у виробництві штучних волокон, в металургії (виробництво алюмінію), в нафтохімічній промисловості та ін.
Про значення водню як палива майбутнього і хімічному реагенте говорилося раніше.
Електроліз розчину NaCl здійснюється двома методами, різними за характером електродних процесів і за апаратурним оформлення:
1. електроліз з твердим катодом і фільтруючою діафрагмою;
2. електроліз без діафрагми з рідким ртутним катодом.
Газоподібні продукти - хлор і водень при будь-якому способі відрізняються високою чистотою. При електролізі з ртутним катодом і третій продукт - розчин гідроксиду натрію має високу концентрацію NaOH і є хімічно чистим. Завдяки чистоті одержуваних продуктів, простому і компактному аппаратурному оформлення, а також одностадійна процес електролізу розчину NaCl є єдиним в світі способом виробництва хлору і основним способом отримання гідроксиду натрію.
Електроліз розчину NaCl з твердим катодом і фільтруючою діафрагмою
При реалізації цього процесу на катоді відповідно до значеннями електроднихпотенціалів протікають наступні процеси:
Матеріалами для катода служить сталь, на якій водень виділяється з відносно невисоким перенапруженням (0,3 В). В реальних умовах електролізу (концентрований розчин NaCl, що містить NaOH, температура 90 ° С) фактичний потенціал виділення водню становить близько - 0,845 В. Зниження потенціалу до 0,3 - 0,4 В можна досягти застосуванням пористих графітових катодів, для зміцнення і гідрофобізації просочених політетрафторетіленом і активованих солями міді або срібла.
Накопичуються в катодному просторі гідроксид-іони утворюють нейтральні молекули гідроксиду натрію
На аноді виділяється хлор:
Матеріалом анода служить оксидно-рутенієвого система (композиція з оксидів рутенію і титану, нанесених на титанову основу), що володіє міцністю і хімічної інертність по відношенню до кисню що є побічним продуктом, що утворюється на аноді:
Крім того, в обсязі електроліту анодного простору в результаті гідролізу хлору йдуть побічні хімічні реакції:
Утворений в результаті цієї послідовної реакції гіпохлорит аніон зазнає анодное окислення
Побічні реакції знижують вихід по струму основних продуктів і підвищують витратні коефіцієнти по енергії. Тому умови електролізу і концентрація електролітів повинні забезпечувати мінімальне протікання побічних реакцій і досягнення максимального виходу по струму цільових продуктів. Для цього електроліз реалізують в електролізерах безперервної дії з вертикальними фільтруючими діафрагмами при противотоке руху електроліту і OH - іонів. Схема електролізера представлена на рис. 1.
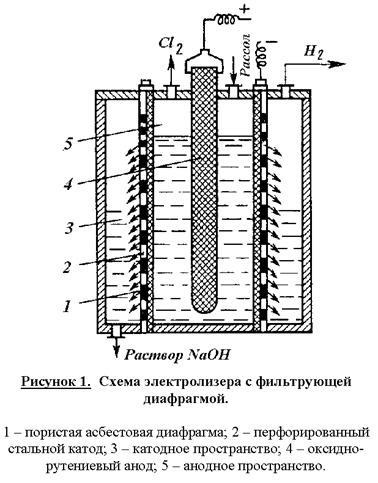
Корпус ванни в цій конструкції розділений на катод і анодное простору пористої діафрагмою з азбесту, модифікованого полімерними речовинами. Діафрагма щільно прилягає до перфорованому скляному катода. В сучасних електролізерах катоди мають гребенчатую розгалужену форму з метою розвитку поверхні. В анодному просторі розташований оксидно-рутенієвого анод. Очищений розсіл подають в анодное простір і внаслідок гідростатичного тиску він фільтрується через діафрагму і катод в катодного простір. З катодного простору безперервно відводять водень і розчин гідроксиду натрію, а з анодного - хлор. В утворюється хлор-газ міститься 95 - 96% Cl2. Хлор-газ охолоджують до 20 ° С (при цьому конденсується вода) та додатково сушать промиванням концентрованої сірчаної кислотою. Катодний продукт - розчин гідроксиду натрію містить 120 - 140 г / л NaOH і 170 - 180 г / л неразложившихся NaCl. Розчин випарюють, при цьому NaCl переходить в тверду фазу, тому що його розчинність різко знижується зі збільшенням концентрації NaOH. Після випарювання і плавки лугів отримують безводні гідроксид натрію, що містить 92 - 95% NaOH і 2 - 4% NaCl.
Завдяки протитечії електроліту і іонів OH -. останні практично не потрапляють в анодное простір і побічні реакції (5), (7) - (9), за які вони відповідальні, гранично мінімізовані.
Електроліз розчину хлориду натрію з ртутним катодом
На ртутному катоді електродні реакції (1) і (2) йдуть з великим перенапруженням - потенціал розряду становить 1,7 - 1,8 В. Натрій виділяється на ртутному катоді з великим ефектом деполяризації і потенціал розряду Na + на ртуті багато нижче стандартного і дорівнює 1,23 В. Явище деполяризації ртутного катода забезпечується тим, що розряд іонів натрію відбувається з утворенням хімічної сполуки - амальгами натрію
яка безперервно відводиться з поверхні анода, розчиняючись в надлишку ртуті. На перфорованому графитовом (або оксидно-рутенієвому) аноді виділяється хлор
Амальгаму натрію, що містить 0,1 - 0,3% Na виводять з електролізера і розкладають нагрітою водою в окремому реакторі-разлагателі. У разлагателі йде електрохімічна реакція, відповідна процесу в короткозамкненим гальванічному елементі NaHg n [NaOH] З в якому амальгама служить катодом
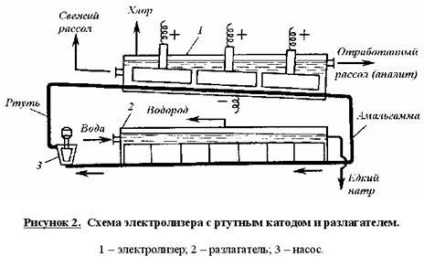
Схема електролізера з ртутним катодом представлена на малюнку 2.
Глибоко очищений концентрований розчин NaCl подають в похилий подовжений електролізер, по дну якого самопливом, противотоком розсолу, рухається ртуть, що служить катодом. Над ртуттю розташований горизонтальний оксидно-рутенієвого (або перфорований графітовий) анод, занурений в розсіл. Анодна рідина, що містить не прореагував NaCl, виводиться з електролізера спільно з хлор-газом, від якого відокремлюється в сепараторах і продувних колонах (на схемі не показані). Хлор подають на осушку, а обесхлоренний розсіл після очищення від ртуті і домішок насичується кам'яною сіллю і повертається в електролізер. Амальгама натрію з електролізера перетікає в похилий реактор-разлагателі, де рухається протитечією дистильованої воді, яка подається в кількості, що забезпечує отримання 45% -ого розчину NaOH. На дні разлагателі розміщені борін графітові плити, які утворюють з амальгамою короткозамкнутий гальванічний елемент NaHg n [NaOH] С. відводяться гідроксид натрію відокремлюють в сепараторах від водню і передають споживачам. Ртуть, що витікає із разлагателі, ртутним насосом перекачують в електролізер.
Оскільки на стадії електролізу луг не утворюється, то в процесі з ртутним катодом виключені побічні реакції (5), (7) - (9) і процес характеризується високим виходом по току і енергії.
Однак, метод електролізу з ртутним катодом вимагає особливо ретельного очищення вихідного циркулюючого розсолу, так як домішки магнію, заліза, кальцію та інших металів знижують перенапруження водню на ртутному катоді, що може привести до порушення катодного процесу і вибухів.
Електроліз з ртутним катодом дає висококонцентровані, хімічно чисті розчини гідроксиду натрію, які необхідні для цілого ряду споживачів, перш за все в виробництві штучних волокон, при синтезі і підготовки іонообмінних матеріалів та ін. Але використання ртуті шкідливо для здоров'я людей. Для отримання хімічно чистих розчинів NaOH почали застосовувати електроліз розчину NaCl з іонообмінної (катіонообменной) мембраною, що розділяє катодного і анодное простору. Цей метод більш складний за апаратурним оформлення та експлуатації апаратури, але значно безпечніше, ніж ртутний. Мембранний метод електролізу, так само як і мембранний, може вважатися маловідходних технологічним процесом.