Способи отримання вуглеводнів ряду дивинила в більшості випадків не відрізняються від способів отримання олефінів, тільки відповідні реакції необхідно проводити двічі або в якості вихідної речовини застосовувати з'єднання, вже містять подвійну зв'язок.
Дивина та ізопрен отримують в промисловості дегидрированием відповідно бутано-бутиленова або ізопентан-ізоаміленових сумішей зазвичай над каталізаторами, що містять Cr2 O3:
2. Дуже велику роль в промисловому виробництві дивинила зіграв метод С. В. Лебедєва:
3. Дивинил, ізопрен, діізопропеніл отримують дегідратацією гликолей:
4. хлорпрен отримують приєднанням хлористого водню до вінілацетілену:
Фізичні властивості 1,3-алкадиенов
Дивина при звичайних умовах - газ. Изопрен і інші найпростіші алкадіени - рідини. Звичайні закономірності, властиві гомологическом рядах вуглеводнів, діють і в цьому ряду.
Для алкадиенов з сполученими подвійними зв'язками характерні аномально високі показники заломлення світла. Завдяки цій особливості знайдені молекулярні рефракції алкадиенов значно більше обчислених. Різниця між знайденої і обчисленої величинами становить зазвичай 1 ÷ 1,5 одиниці. Вона називається молекулярною екзальтацією.
Хімічні особливості 1,3-алкадиенов
Дві пов'язані π-зв'язку утворюють загальне електронне хмара - всі чотири вуглецевих атома знаходяться в стані sp 2-гібридизації (див. Розділ 2). Це призводить до вкорочення простий зв'язку (до 0,146 нм) і до стабілізації молекули. Так, наприклад, енергія утворення молекули дивинила на 14,6 кДж / моль більше в порівнянні з обчисленої енергією освіти вуглеводню того ж складу, але без урахування сполучення подвійних зв'язків. Цю різницю називають енергією резонансу. Ця особливість в будові дієнових вуглеводнів робить їх здатними приєднувати різні речовини не тільки по одній з подвійних зв'язків, а й до крайніх атомів пов'язаною системи - в 1,4-положення з переміщенням подвійного зв'язку. Таке приєднання визначається динамічним ефектом сполучення, тобто перерозподілом електронної густини молекули під впливом атакуючого агента.
Каталітично збуджений водень приєднується в 1,2- і 1,4-положення:
Галогени також здатні приєднуватися до зв'язаних систем в 1,2- і 1,4-положення:
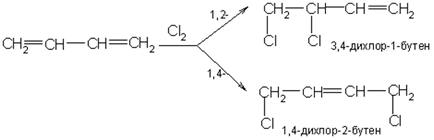
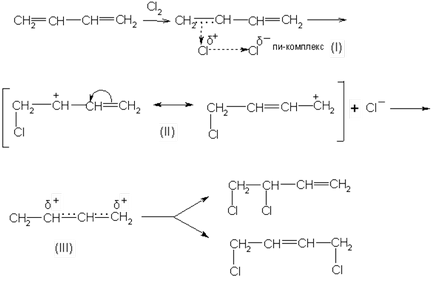
Як і в разі етиленових вуглеводнів, приєднання може проходити як за іонним, так і по радикальному механізму.
При іонному механізмі приєднання спочатку виникає π-комплекс (I) швидко перетворюється в пов'язаний карбонієвого іон з позитивним зарядом на другому і четвертому вуглецевих атомах. Цей іон можна зобразити або двома граничними формулами (II) або однією формулою (III). Цей карбкатион приєднує аніон галогену з утворенням продуктів 1,2- і 1,4-приєднання:
У реакціях приєднання галогеноводородов діють ті ж закономірності:
Гіпогалогенітние кислоти і їх ефіри приєднуються переважно в 1,2-положення:
При нагріванні молекули дієнових вуглеводнів здатні приєднуватися один до одного таким чином, що одна з них реагує в 1,2, а інша в 1,4 положеннях. Одночасно в невеликих кількостях утворюється продукт, коли обидві молекули реагують в 1,4-положення:
Дієнових вуглеводні особливо легко димеризуется з молекулами, що мають активовану подвійну зв'язок. Реакції цього типу називаються дієновим синтезом або реакціями Дильса-Альдера:
Важливою особливістю дієнових вуглеводнів з сполученими зв'язками є їх здатність полимеризоваться в каучукоподобное продукти.
Промисловий інтерес представляє ланцюгова полімеризація дієнових вуглеводнів під впливом каталізаторів або ініціаторів. В якості каталізаторів використовуються лужні метали, металоорганічні сполуки, як ініціатори - органічні і неорганічні пероксиди.
При полімеризації окремі молекули мономерів можуть з'єднуватися один з одним в 1,2, в 1,4-положення або одна молекула реагує в 1,2, а інша - в 1,4 становище:
Швидкість полімеризації залежить від будови диенов і умов полімеризації. Заступники в середині молекули полегшують, а на кінці молекули ускладнюють полімеризацію. Изопрен полимеризуется швидше, а піперілен повільніше, ніж дивинил.
Найбільш цінні продукти виходять при стереорегулярность (просторово впорядкованої) полімеризації в 1.4-положення з утворенням цис-конфігурації кожного залишку:
За хімічним складом і будовою натуральний каучук являє собою стереорегулярний цис-полімер ізопрену.
Будова каучуку і інших полімерів дієнових вуглеводнів було доведено методом озонування (по Гаррієс). Отримання при Озонолиз левулінова альдегіду підтверджує впорядковане 1,4-будова.
Різні види синтетичного і натурального каучуку широко застосовуються в промисловості. Піонером в організації великого промислового виробництва синтетичного каучуку був Радянський Союз.
ЗАВДАННЯ для самоперевірки
1. Розрахувати масу (г) 1,3-бутадієну, що утворюється в результаті дегідрування 20 дм 3 бутану (н. У.), Якщо вихід бутадієну складає 50%.
2. При пропущенні 200 дм 3 (при н. У.) Парів етилового спирту над дегидратирующим і дегидрирующей каталізаторами було отримано 90 дм 3 газоподібного (при н. У.) Дивинила. Визначити вихід реакції.
3. Розрахуйте максимальну масу (г) брому, який може приєднатися до 1,3-бутадієну, якщо його обсяг становить 12 дм 3 (умови нормальні).
4. При окисленні по Гаррієс непредельного вуглеводню отриманий ацетон, маса якого дорівнювала 29 м Визначити масу (в г) непредельного вуглеводню, що вступив у реакцію, виходячи з припущення, що вихід продуктів озоноліза - кількісний.
5. Назвіть вуглеводень з міжнародної номенклатурі
6. Написати структурну формулу 2,5-диметил-4-ізопропіл-1,5-гексадіена.
3.4. Алкінілу: визначення, ізомерія, номенклатура
Алкінілу називають вуглеводні, що містять крім # 963; -зв'язків дві π-зв'язку (потрійний зв'язок) в однієї пари вуглецевих атомів. Загальна формула гомологічного ряду ацетиленових вуглеводнів Сn H2n-2. Родоначальником цього ряду є ацетилен.
Ізомерія і номенклатура
Ацетиленові вуглеводні за номенклатурою ІЮПАК називають, користуючись тими ж правилами, що і в разі граничних вуглеводнів, але суфікс «ан» замінюється суфіксом «ін». Головний ланцюг вибирається так, щоб в неї потрапила потрійний зв'язок, а нумерується з того кінця, до якого ближче потрійний зв'язок.
Найпростіші ацетиленові вуглеводні часто називають як алкілзаміщених ацетилену, тобто по раціональної номенклатурі:
Ізомерія ацетиленових вуглеводнів визначається як будовою вуглецевого скелета, так і положенням потрійного зв'язку.
Ацетиленові вуглеводні отримують або алкилированием ацетилену, або отщеплением галогеноводородов або галогенів від полігалогенопроізводних.
1. Ацетилен можна отримати при високотемпературному крекінгу метану:
а також при гідролізі карбіду кальцію:
2. Алкилирование ацетилену здійснюють, перетворюючи ацетилен в металоорганічні сполуки:
CH≡C-Na + СH3 J → CH≡C-СH3 + NaJ
3. Ацетиленові вуглеводні утворюються при дії спиртової лугу на дігалогенопроізводние граничних вуглеводнів, що містять галогени у одного або сусідніх атомів вуглецю:
Основні закономірності в зміні температур кипіння і плавлення в гомологічної ряду ацетиленових вуглеводнів подібні до закономірностей в ряду етиленових і граничних вуглеводнів.
Положення потрійний зв'язку в ланцюзі ще більше впливає на температуру кипіння. Так, наприклад, 1-бутин кипить при 8,5 о С, а 2-бутин - при 27 о С, тоді як обидва бутану і все бутилен при звичайних умовах - речовини газоподібні.
Щільність і показник заломлення алкинов значно вище, ніж у алкенів і тим більше алканів.
Ацетиленові вуглеводні мають в інфрачервоному спектрі характерні смуги поглинання валентних коливань потрійний зв'язку при 4,75 - 4,2 мкм (2100 - 2300 см -1.
При розгляді хімічних властивостей алкинов слід враховувати особливості потрійний зв'язку: в порівнянні з алкенами Алкіни кілька менш активні в реакціях електрофільного приєднання і активніші в реакціях з нуклеофилами (вода, алкоголяти, аміни). Ці особливості ацетиленового угруповання пояснюються її будовою. Обидва вуглецевих атома в ацетилені знаходяться в sp-гібридному стані. Тим часом, чим більше частка s-орбіталі в гібридному стані, тим ближче електрони знаходяться до ядра і, отже, тим важче ці електрони залучаються до хімічні перетворення за участю електрофілов. З іншого боку, ядра вуглецю в ацетилені набагато доступніші для нуклеофільних реагентів завдяки його лінійному будові:
Цей же фактор обумовлює і значну СН-кислотність кінцевий ацетиленового угруповання. Електронна пара З-Н зв'язку в молекулі ацетилену ближче до ядра, ніж у випадку етилену, і атом водню більш позитивно поляризований.
Водень приєднується за місцем потрійного зв'язку в присутності тих же каталізаторів, що і за місцем подвійного зв'язку:
Приєднання галогенів (хлору, брому, йоду) до алкінілу по електрофільні механізму також йде з меншою швидкістю, ніж до олефінам. Утворені при цьому ненасичені дігалогенопроізводние можна виділити з реакційної суміші:
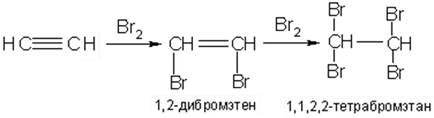
Приєднання галогеноводородов до алкінілу призводить до суміші етиленових моногалогенозамещенних і граничних дігалогенозамещенних вуглеводнів:
Реакції приєднання галогенів і галогеноводородов до алкінілу можуть проходити за механізмом електрофільного або радикального приєднання. При електрофільного приєднання дотримується правило Марковникова, при радикальному механізмі спостерігається протилежний зміст приєднання.
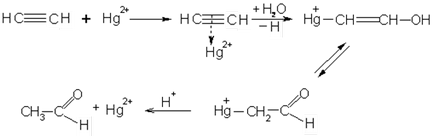
Алкіни легко приєднують воду і кислоти на відміну від алкенів. Приєднання води ведуть у присутності сульфату ртуті - реакція Кучерова. При цьому з ацетилену виходить оцтовий альдегід, а з його гомологів - кетони:
Реакцію ацетилену з водою використовують в промисловості для отримання оцтового альдегіду. Можливий механізм реакції Кучерова:
Спирти приєднуються до алкінілу в присутності алкоголятов. Цим способом отримують вінілові ефіри, а також ацетали:
Приєднання спиртів в присутності алкоголятов - це типова реакція нуклеофільного приєднання. Її механізм можна представити таким чином: