Мета заняття: застосування теоретичних знань для вирішення задач.
Підготовка до заняття: лекції № 22-25. Касьянов В.А. Фізика-10 § 37, 39-44.
1. Скільки молекул міститься в вуглекислому газі (CO2) масою 20 г?
2. Розрахуйте тиск, яке виробляють молекули газу на стінки посудини, якщо маса газу 3 г, обсяг 0,5 × 10 -3 м 3. а середня квадратична швидкість молекул 500 м / с.
3. Яка середня квадратична швидкість молекул гелію при 27 ° C?
4. У процесі ізохоричного охолодження тиск газу зменшилася в 3 рази. Якою була початкова температура газу, якщо кінцева температура стала рівною 27 ° C?
5. При тиску 10 5 Па і температурі 15 ° C повітря має об'єм 2 л. При якому тиску повітря даної маси займе обсяг 4 л, якщо температура його стане рівною 20 ° C?
6. Яка внутрішня енергія одноатомного газу, що займає при температурі 400 К об'єм 2,5 л, якщо концентрація його молекул 10 20 см -3?
7.
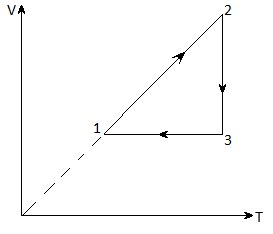
8. На малюнку дано графік зміни стану ідеального газу в координатах V - T. Уявіть цей процес на графіках в координатах p - V і p - T.
9. Оцініть діаметр атома вуглецю, знаючи значення щільності алмазу, яка дорівнює 3515 кг / м 3.
1. Знайти число атомів в свинцевому предмет масою 234 р
2. Визначте, при якій температурі середня квадратична швидкість молекул кисню дорівнює 500 м / с.
3. Скільки молекул міститься в 2 м 3 газу при тиску 150 кПа і температурі 27 ° C?
4. У балоні об'ємом 200 л знаходиться гелій під тиском 100 кПа при температурі 17 ° C. Після підкачування гелію його тиск піднявся до 300кПа, а температура збільшилася до 47 ° C. На скільки збільшилася маса гелію?
5. В процесі ізобарного охолодження обсяг ідеального газу зменшився в 2 рази. Яка кінцева температура газу, якщо його початкова температура дорівнює 819 ° C? Маса газу постійна.
6. Газ, розширюючись ізобарно при додаванні 2 • 10 5 Па, здійснює роботу 200 Дж. Визначте первинний об'єм газу, якщо його кінцевий обсяг дорівнював 2,5 л.
7.
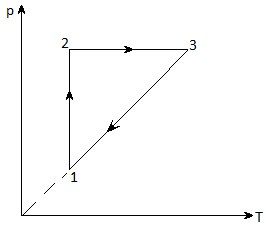
У циліндрі об'ємом 24 л знаходиться газ, який ізобарно розширюється під тиском 5 • 10 5 Па. Який кінцевий обсяг газу, якщо при його розширенні відбувається робота в 1,5 кДж?
8. На малюнку дано графік зміни стану ідеального газу в координатах p - T. Уявіть цей процес в координатах p - V і V - T.
9. У озеро, що має середню глибину 10 м і площа поверхні 20 км 2. кинули кристалик кухонної солі масою 0,01 г. Скільки молекул солі виявилося б в наперстку води об'ємом 2 см 3. зачерпнути з озера, якщо вважати, що сіль, розчинившись, рвномерно розподілилася в усьому обсязі води?
1. Записати найменування та мета заняття.
2. Відповісти на контрольні питання і отримати допуск до роботи.
3. Виконати завдання.
1. Сформулювати основні положення МКТ.
2. Записати число Авогадро. Як розрахувати число молекул речовини?
3. Записати залежність температури від середньої кінетичної енергії. Чому дорівнює постійна Больцмана? Як перевести значення температури, вираженої в градусах Цельсія в Кельвіна?
4. Записати основне рівняння МКТ та універсальну газову постійну.
5. Сформулювати газові закони для даної маси газу.
Молекулярно-кінетичної теорії називають вчення про будову і властивості речовини на основі уявлення про існування атомів і молекул як найменших частинок хімічної речовини.
В основі молекулярно-кінетичної теорії лежать три основних положення:
1. Будь-яка речовина складається з найдрібніших частинок - молекул і атомів. Вони розташовані в просторі дискретно, тобто на деяких відстанях один від одного.
2. Атоми або молекули речовини знаходяться в стані хаотичного руху. яке ніколи не припиняється.
3. Атоми або молекули речовини взаємодіють один з одним силами тяжіння і відштовхування, які залежать від відстаней між частинками.
Атом - це найменша частинка даного хімічного елемента, яка зберігає всі його хімічні властивості. Хімічних елементів не так багато - всі вони зведені в таблицю Менделєєва.
Молекула - це найменша частинка даної речовини (що не є хімічним елементом), яка зберігає всі його хімічні властивості. Молекула складається з двох або більше атомів одного або декількох хімічних елементів.
Кількість речовини-фізична величина, що характеризує кількість однотипних структурних одиниць, що містяться в речовині.
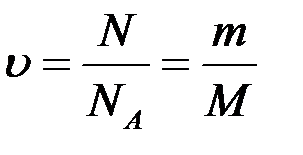
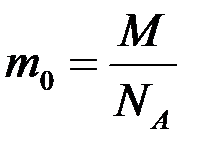
Моль - це кількість речовини, що дорівнює 6,02. 10 23 структурних одиниць даної речовини - молекул (якщо речовина складається з молекул), атомів (якщо це атомарний речовина), іонів (якщо речовина є іонним з'єднанням).
Основне рівняння МКТ:
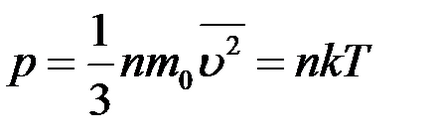
Рівняння стану ідеального газу:
Ізопроцесси і газові закони:

Практичне заняття № 6.