модель Томсона
Перша модель будови атома була запропонована Дж. Томсоном в 1904 р згідно з якою атом - позитивно заряджена сфера з вкрапленнями в неї електронами. Незважаючи на свою недосконалість томсоновская модель дозволяла пояснити явища випускання, поглинання і розсіяння світла атомами, а також встановити число електронів в атомах легких елементів.

Мал. 1. Атом, згідно моделі Томсона. Електрони утримуються всередині позитивно зарядженої сфери пружними силами. Ті з них, які знаходяться на поверхні, можуть легко «вибиватися». залишаючи іонізований атом.
2.2 Модель Резерфорда
Модель Томсона була спростована Е. Резерфордом (1911 г.), який довів, що позитивний заряд і практично вся маса атома сконцентровані в малій частині його обсягу - ядрі, навколо якого рухаються електрони (рис. 2).
Мал. 2. Ця модель будови атома відома як планетарна, т. К. Електрони обертаються навколо ядра подібно до планет сонячної системи.
Відповідно до законів класичної електродинаміки, рух електрона по колу навколо ядра буде стійким, якщо сила кулонівського тяжіння буде дорівнює відцентрової сили. Однак, відповідно до теорії електромагнітного поля, електрони в цьому випадку повинні рухатися по спіралі, безперервно випромінюючи енергію, і падати на ядро. Однак атом стійкий.
До того ж при безперервному випромінюванні енергії у атома повинен спостерігатися безперервний, суцільний спектр. Насправді спектр атома складається з окремих ліній і серій.
Таким чином, дана модель суперечить законам електродинаміки і не пояснює лінійного характеру атомного спектра.
2.3. модель Бора
У 1913 р Н. Бор запропонував свою теорію будови атома, не заперечуючи при цьому повністю попередні уявлення. В основу своєї теорії Бор поклав два постулати.
Перший постулат говорить про те, що електрон може обертатися навколо ядра тільки по певним стаціонарним орбітам. Перебуваючи на них, він не випромінює і не поглинає енергію (рис.3).
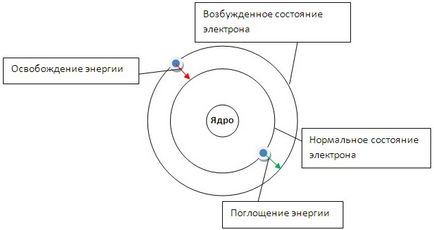
Мал. 3. Модель будови атома Бора. Зміна стану атома при переході електрона з однієї орбіти на іншу.
При русі по будь стаціонарної орбіті запас енергії електрона (Е1, Е2 ...) залишається постійним. Чим ближче до ядра розташована орбіта, тим менше запас енергії електрона Е1 ˂ Е2 ... ˂ Еn. Енергія електрона на орбітах визначається рівнянням:
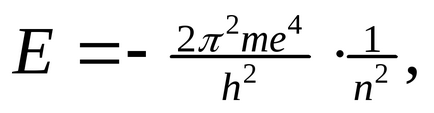
де m - маса електрона, h - постійна Планка, n - 1, 2, 3 ... (n = 1 для 1-ої орбіти, n = 2 для 2-ий і т.д.).
Другий постулат говорить про те, що при переході з однієї орбіти на іншу електрон поглинає або виділяє квант (порцію) енергії.
Якщо піддати атоми впливу (нагрівання, опромінення і ін.), То електрон може поглинути квант енергії і перейти на більш віддалену від ядра орбіту (рис. 3). У цьому випадку говорять про збудженому стані атома. При обратом переході електрона (на ближчу до ядра орбіту) енергія виділяється у вигляді кванта променистої енергії - фотона. В спектрі це фіксується певною лінією. На підставі формули
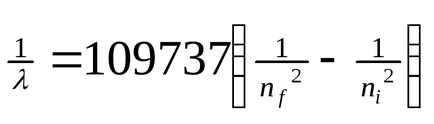
де λ - довжина хвилі, n = квантові числа, що характеризують ближню і дальню орбіти, Бор розрахував довжини хвиль для всіх серій в спектрі атома водню. Отримані результати відповідали експериментальним даними. Стало зрозумілим походження переривчастих лінійчатих спектрів. Вони - результат випромінювання енергії атомами при переході електронів із збудженого стану в стаціонарне. Переходи електронів на 1-ю орбіту утворюють групу частот серії Лаймана, на 2-ю - серію Бальмера, на 3-ю серію Пашена (рис. 4, табл. 1).
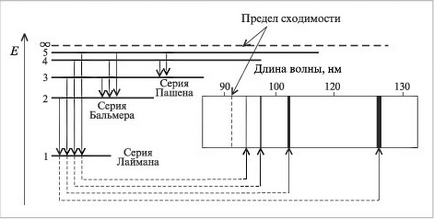
Мал. 4. Відповідність між електронними переходами і спектральними лініями атома водню.
Перевірка формули Бора для серій водневого спектра