Адсорбція електролітів залежить від природи адсорбенту. Іони, здатні поляризуватися, адсорбуються тільки на поверхні з полярних молекул або іонів. Чим більше радіус іона адсорбата при однаковому заряді, тим краще він адсорбується. Це обумовлено більшою поляризуемостью і меншою гидратацией великих іонів. За здатністю адсорбуватися можна скласти наступні ряди:
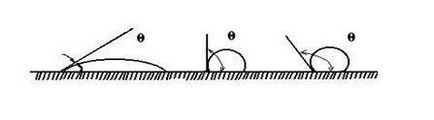
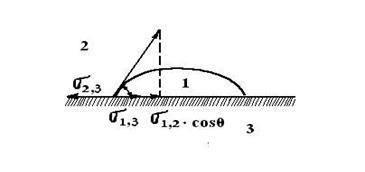
Li + Mg 2+ Cl - K + < Обмінна адсорбція спостерігається в тому випадку, якщо на поверхні адсорбенту вже адсорбований іон. Тоді обмін може йти між подвійним електричним шаром адсорбенту і середовищем. Обмін іонами при цьому відбувається в еквівалентних кількостях. Для обмінної адсорбції має місце ряд особливостей. 1. Обмінна адсорбція специфічна: до обміну здатні тільки певні іони. Розрізняють кислотні та основні адсорбенти. Кислотні адсорбенти обмінюють з розчинами катіони, а основні - аніони. Існують і амфотерні адсорбенти, здатні на обмін іонів обох видів. 2. Обмінна адсорбція не завжди оборотна. 3. Обмінна адсорбція протікає повільніше, ніж молекулярна адсорбція. 4. При обмінної адсорбції може змінюватися рН середовища. адсорбент - H + + Na + + Cl - ® адсорбент - Na + + H + + Cl -; адсорбент + OH - + Na + + Cl - ® адсорбент + Cl - + Na + + OH -. Обмінна адсорбція має велике значення в біології, землеробстві, техніці. Грунт поглинає іони калію, амонію, виділяє іони кальцію, магнію, майже не поглинає хлорид-, нітрат, сульфат-іони. Здатністю до поглинання має високодисперсна суміш нерозчинних алюмосиликатов грунту. Для очищення води, концентрування розчинів широко застосовуються іонообмінні смоли. Обмінна сорбція спостерігається на вугіллі, хоча він не має полярність. Для пояснення цього факту А. Н. Фрумкин запропонував наступну схему. Вугілля адсорбує молекулу водню, який при контакті з адсорбентом утворює іон водню: угольH2 ® вугілля 2 2H + Цей комплекс здатний до іонного обміну: вугілля - H + + Na + + Cl - ® вугілля - Na + + H + + Cl -. угольО2 ® вугілля 4+ 2О 2, вугілля 2+ O 2 + Н2 Про ® вугілля 2+ 2ОН -, вугілля + OH - + Na + + Cl - ® вугілля + Cl - + Na + + OH -. Змочування визначається інтенсивністю взаємодії між молекулами різних речовин, і в цьому сенсі явище близько до адсорбції. При змочуванні твердого тіла рідиною спостерігається розтікання краплі по поверхні аж до утворення моношару. Змочування не завжди буває повним, в цьому випадку між краплею і поверхнею утворюється так званий кут змочування. Його величина може бути більше, або менше 90 0. як це показано на рис. 4.2. Прийнято проводити вимірювання кута змочування з боку рідкої фази. Мал. 4.2. Кут змочування для рідин різної природи Змочування твердого тіла рідиною можна розглядати як результат дії сил поверхневого натягу. Візьмемо випадок неповного змочування, представлений на рис.4.3. Окружність краплі є кордоном взаємодії трьох середовищ: рідини 1, повітря 2 і твердого тіла 3. Мал. 4.3. Залежність крайового кута від поверхневих натягів на різних кордонах розділу: 1 - рідина; 2 - повітря .; 3 - тверде тіло Умова рівноваги виражається рівнянням Юнга: Змочування супроводжується зменшенням поверхневої енергії Якщо поверхня знаходиться в контакті з полярної водою і неполярних вуглеводнем, спостерігається виборче змочування. В цьому випадку крайової кут змочування менше 90 0. і така поверхня називається гідрофільної. Якщо тверде тіло краще змочується неполярних розчинником, то для води крайовий кут змочування більше 90 0. і поверхня називається гідрофільної. Виборче змочування водою спостерігається тоді, коли різниця полярностей між водою і твердим речовиною менше, ніж між неполярних вуглеводнем і твердою речовиною. До речовин з гідрофільної поверхнею відносяться кварц, корунд, гіпс, оксиди і гідроксиди металів, целюлоза. Виборче змочування неполярних вуглеводнем спостерігається тоді, коли різниця полярностей між вуглеводнем і твердою речовиною менше, ніж між речовиною і водою. До гідрофобним речовин відносяться вуглеводні, сульфіди важких металів, тальк, графіт, сірка. Крайовий кут вимірюють експериментально, хоча при цьому існує ряд труднощів. На величину кута впливають сліди забруднень поверхні, наявність плівки оксиду, адсорбований повітря, шорсткість, умови утворення поверхні. Змочування грає велику роль в технологічних процесах, наприклад, при флотації. В основі методу лежить використання відмінностей в смачиваемости поділюваних часток водою. Розглянемо поведінку малих гідрофобних і гідрофільних часток на межі поділу вода-повітря і вода-масло. Гідрофільні частки на обох кордонах будуть втягуватися в воду і тонути. Гідрофобна частка залишається на межі поділу за умови, що вона не дуже важка. Сірчисті з'єднання руд більш гідрофобні, ніж порожня порода (кварц). Для більшої ефективності в пульпу вводять повітря (пінна флотація). При Спливання бульбашки збирають на своїй поверхні ті частинки, на яких вода утворює великий крайової кут. Так на поверхні пульпи утворюється мінералізована піна, яку видаляють у вигляді концентрату. Оптимальний розмір зерен мінералу при флотації 0,15-0,01 мм. Для підвищення ефективності флотації застосовують колектори. Це дифільні органічні сполуки, які адсорбуються на поверхні мінералу так, що полярна частина звернена до адсорбентів, а радикал назовні. Гідрофобність частки при цьому зростає. Часто для цих цілей використовують ксантогенати - ROCS2 M, де М - лужний метал. Близька до явищ змочування і адсорбції адгезія. Це явище виникає в тому випадку, коли дві взаємно нерозчинних рідини або рідина і тверде тіло, або два твердих тіла наводяться в зіткнення і прилипають один до одного під дією міжмолекулярних сил. Робота адгезії двох рідин визначається за рівнянням Дюпре. Для системи рідина - тверде тіло Крім адгезії розрізняють ще когезию: злипання двох шарів одного і того ж речовини.
Схожі статті