Молекули, що складаються з двох однакових атомів, як, наприклад, H2 або Cl2, завжди є чисто ковалентними сполуками. Однак, коли ковалентним зв'язком з'єднані два різних атома, що зв'язують електрони усуспільнюється між ними нерівномірно. Це обумовлено неоднаковою здатністю таких двох атомів притягувати до себе електрони. В результаті утворюється полярна ковалентний зв'язок. Такий зв'язок характеризується наявністю на одному з атомів невеликого позитивного заряду, а на іншому атомі-невеликого негативного заряду. Зв'язок з двома різнойменними за знаком зарядами є електричний диполь. Заряди такого диполя позначаються 5+ і 5 -. Символ 5 означає, що заряди невеликі (менше заряду одного електрона). Кількісною мірою електричного диполя є твір відстані між двома зарядами на величину заряду, такий твір називається електричний дипольний момент.
Величина зарядів, що виникають при утворенні полярної ковалентного зв'язку, залежить від відмінності в здатності притягувати електрони у двох атомів, пов'язаних такий ковалентним зв'язком. Здатність атома притягувати електрони прийнято називати його електронегативність. Для кількісного визначення електронегативності запропоновано кілька шкал. Найчастіше використовується шкала електронегативності, яку запропонував Л. Полінг. Побудова цієї шкали засноване на експериментальних значеннях ентальпії утворення зв'язків в двоатомних молекулах.
Електронегативність елементів періодичної системи послідовно зростає при переміщенні зліва направо вздовж кожного періоду. У межах кожної групи (за винятком частини елементів групи Ш) електронегативність послідовно убуває при переміщенні зверху вниз. У табл. 2.2 вказані електронегативності деяких елементів, обчислені Полингом. У шкалі Полінга електронегативність фтору (найбільш електронегативного з усіх елементів) умовно прийнята рівною 4,0. Відзначимо, що електронний торгівельний є безрозмірною величиною.
Наведемо кілька прикладів, які показують, як користуватися даними табл. 2.2 для оцінки іонного характеру ковалентних зв'язків.
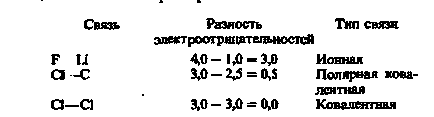
Чим більше різниця електронегативності, тим більше частка іонного характеру, або ступінь ионности зв'язку. Різниця електронегативності, рівна 2,1, відповідає приблизно 50% -ному іонного характеру. Зв'язки з різницею електроотріцательностей більше 2,1 можуть вважатися іонними. Зв'язки з меншою різницею електроотріцательностей відносять до полярним ковалентним зв'язкам. Чим менше різниця електронегативності, тим менше ступінь ионности зв'язку. Нульова різниця електронегативності вказує на відсутність іонного характеру і, отже, на чисто ковалентний зв'язок.
Позитивний заряд на катіоні в іонному поєднанні може притягувати до себе електрони від сусіднього аниона. Це призводить до спотворення електронного хмари аниона (див. Рис. 2.11). Таке спотворення називається поляризацією. Здатність катіона притягувати електрони і поляризувати аніон називається його поляризующей здатністю. Ступінь поляризації іонного зв'язку є мірою ступеня ковалентності зв'язку. Карти електронної щільності чисто іонних з'єднань, наприклад фториду літію, що не виявляють ніякого спотворення.
У 1923 р К. Фаянс висунув припущення, що всі з'єднання характеризуються певним ступенем ковалентності. Далі він припустив, що поляризація іонної
Ці три правила називаються правилами Фаянсу.