Поверхневий натяг відноситься до числа найбільш важливих властивостей дисперсних систем і є основною термодинамічної характеристикою поверхні розділу. Розглянемо найбільш простий випадок - поверхневий натяг рідини на кордоні з газом (рис. 2.1).
Мал. 2.1. міжмолекулярної взаємодії
всередині рідини і на поверхні розділу фаз
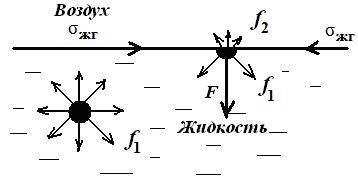
На молекулу, що знаходиться всередині рідини, діють сили взаємного тяжіння (сили молекулярного зчеплення) з боку всіх оточуючих її сусідніх молекул. Рівнодіюча цих сил дорівнює нулю внаслідок симетрії силового поля, і для переміщення молекули всередині рідини не потрібно витрачати роботу. Це викликано тим, що в газоподібній фазі молекули віддалені один від одного на великі відстані, і діють між ними сили взаємного тяжіння дуже малі. Молекули, що знаходяться на межі поділу фаз, відчувають дію міжмолекулярних сил більшою мірою з боку рідкої фази f1. ніж з боку газоподібної f2 (f1 >> f2). Результуюча сила F. пропорційною різниці сил (f1- f2), спрямована всередину рідини. Ця сила, віднесена до одиниці поверхні (1 м 2 або 1 см 2), називається внутрішнім (молекулярним) давленіемpM:
Молекулярне тиск визначається силою зчеплення молекул, воно тим вище, ніж полярні речовина, так для H2 O величина рМ дорівнює 14000 атм, для C6 H6 - 3800 атм. Таким чином, на поверхні будь-якої рідини існує величезний тиск, викликане нескомпенсованність молекулярних сил зчеплення в поверхневому шарі і прагне затягнути все молекули з поверхні всередину рідкої фази. Цим пояснюється куляста форма крапель рідини.
Поверхневий шар внаслідок нескомпенсованність молекулярних сил має надлишкову вільну енергію в порівнянні з об'ємом рідини. Цей надлишок вільної енергії, віднесений до одиниці поверхні (1 м 2 або 1 см 2), називається питомою вільної поверхневою енергією (поверхневий натяг). Весь надлишок поверхневої енергії укладено в шарі товщиною в 1 молекулу. Наявність на поверхні розділу фаз надлишку енергії означає, що для утворення нової поверхні потрібно зробити роботу.
Поверхневий натяг () - робота оборотного ізотермічного процесу, витрачена на освіту одиниці площі поверхні розділу фаз (енергетичне визначення поверхневого натягу):
Знак мінус говорить про те, що позитивна робота відбувається при зменшенні або скорочення поверхні.
Силове визначення: поверхневий натяг - сила, спрямована тангенціально (паралельно) до поверхні і яка припадає на одиницю довжини периметра, що обмежує цю поверхню.
Фізична сутність - поверхневі молекули прагнуть піти вглиб конденсованої фази, тим самим, стискаючи поверхню.
Обидва ці визначення необхідно розглядати в єдності. Така єдність енергетичного і силового підходів склалося історично. Величина поверхневого натягу була введена в фізику задовго до появи поняття енергії і розглядалася як сила, стягуюча гіпотетичну плівку на поверхні рідини і протидіє її розтягування. Силове визначення більш справедливо для рідин, тому що у них одночасно з утворенням поверхні молекули й атоми на ній орієнтуються, ущільнюються, переходячи в рівноважний стан і викликаючи тим самим тангенціальне натяг поверхні.
2.2.2. термодинамічне визначення
поверхневого натягу
При p і Т = const запишемо об'єднане рівняння першого і другого почав термодинаміки для гетерогенної системи щодо зміни енергії Гіббса:
де Т - температура; S - ентропія; р - тиск; V - об'єм; s - площа поверхні; - поверхневий натяг; - хімічний потенціал i- го компонента; ni - число моль i -го компонента; - електричний потенціал; q - кількість електрики.
Поверхневий натяг є приватна похідна від енергії Гіббса по площі поверхні розділу фаз при постійних: тиск, температуру, зокрема моль компонентів і заряді.
Так як об'єднане рівняння першого і другого почав термодинаміки може бути записано і щодо інших термодинамічних потенціалів, а саме внутрішньої енергії U. енергії Гельмгольца А. і ентальпії H. то при відповідних постійних параметрах отримаємо
Поверхневий натяг - приватна похідна від будь-якого термодинамічного потенціалу по площі міжфазної поверхні при постійних відповідних параметрах.
Найбільш часто поверхневий натяг висловлюють через похідну від енергії Гіббса, тому що експериментальні умови сталості T і p легко здійсненні експериментально.
Поверхневий натяг індивідуальних речовин є в той же час питомою енергією Гіббса поверхні (енергією Гіббса, що припадає на одиницю площі поверхні):