У процесі життєдіяльності в будь-якому живому організмі вдосконалення-шаются найскладніші і різноманітні перетворення хімічних речовин різної природи. Переважна більшість, а по які-яким даними навіть всі хімічні реакції в живих організ-мах протікають за участю біологічних каталізаторів - фер-ментів. Цим і пояснюється легкість проходження цих реакцій.
Ферментативний каталіз істотно відрізняється від химиче-ського каталізу. Ці відмінності зводяться до наступного.
Каталітична активність. За активністю біологічні ката-лизатор в мільйони разів перевершують активність хімічних ка-талізаторов. Навіть найкращий з неорганічних каталізаторів - атомна платина - поступається, наприклад, ферменту каталази по ак-тивності в розрахунку на 1 активний центр в тисячі разів. Про швидкість ферментативних реакцій можна судити за наступним прикладом: 1 моль ферменту сахарози здатний розщепити в 1 від 1000 моль бурякового цукру.
Мізерно малі кількості ферментів здатні розщеплювати велику кількість реагуючих речовин. Так, 1 г кристалічного пепсину розщеплює 50 кг коагулированного яєчного білка, а 1 г кристалічного реніну згортає 72 т молока. Фермент пероксидаза, який прискорює окислення субстрату за рахунок пероксиду водню, проявляє свою активність при розведенні 1 мас. ч. ферменту в 500 000 000 мас. ч. води.
Згідно з рекомендацією міжнародної комісії з Номенкл-турі ферментів каталітична активність ферменту може бути охарактеризована його «молекулярної активністю», під якою слід розуміти число молекул даного субстрату або еквівалент-тов порушених груп, що перетворюються за 1 хв однієї молекулою ферменту при оптимальній концентрації субстрату.
Висока хімічна специфічність. На відміну від хімічних каталізаторів ферменти мають значно більшу спеці-фічностью: кожен з них діє лише на строго визначений-ву реакцію або групу реакцій, що протікають в організмі. Передбачається, що в організмі людини одночасно функцио-нує близько 1000 різних ферментів. При цьому вони утворюють складні ферментативні системи, які забезпечують в живій клітині перебіг цілого ряду строго послідовних і злагоди-сова між собою реакцій. Якби ферменти не мали такої високої специфічністю, це призвело б до швидкого роз-ду всіх речовин в клітинах і до загибелі всього організму.
Специфічність ферментів підрозділяється на абсолютну (або хімічну) і стереохимическую.
Абсолютна специфічність - це дія кожного ферменту на речовина чітко визначеного хімічного складу. Наприклад, фермент уреаза каталізує тільки гідроліз сечовини, фермент пепсин - тільки розчеплення білків, каталаза діє лише на пероксид водню.
Стереохімічна специфічність полягає в тому, що фер-менти діють тільки на певні стереоізомери органіч-ських з'єднань. Як приклад подібної специфічності мож-но вказати на дію двох ферментів: # 945; - і # 946; -глюкозідази. Фер-мент # 945; -глюкозідаза діє тільки на # 945; -глюкозіди, а # 946; -глюкозідаза - на # 946; -глюкозіди, що добре видно на наведеній схемі:
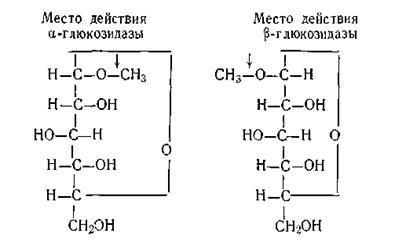
Причини такої високої специфічності ферментів ще до кінця не вивчені. Існує цілий ряд теорій, що пояснюють механізм дії ферментів.
Так, німецький хімік Фішер для пояснення специфічності ферменту по відношенню до даного субстрату свого часу перед-покладав гіпотезу «замку і ключа». Відповідно до цієї гіпотези молекула субстрату точно відповідає за своєю формою деякої ділянки на молекулі ферменту. Фішер вважав, що «ключ» - субстрат точ-но підходить до ферменту - «замку» без якого б то не було нару-шення форми обох молекул. Однак, як показали дослідження, в ряді випадків гіпотеза Фішера не може пояснити деякі факти.
Для того щоб привести цю теорію у відповідність з досвідченими даними, Кошланд кілька видозмінив модель «ключ - замок». Згідно з його гіпотезою субстрат, приєднуючись до активного центру, змінює його форму, забезпечуючи таким чином ідеальне їх від-ветствие. Іншими словами, функціональні групи в активному центрі приймають специфічну просторову конфігурацію тільки тоді, коли їх змушує до цього присутність суб-страта.
Так, освіта фермент-субстратного комплексу може про-виходити за рахунок електрично заряджених угруповань як на ферменті, так і на субстраті. Такими угрупованнями можуть бути
В результаті такої взаємодії в субстраті можуть происхо-дить певні хімічні зміни, що виражаються в обра-зовании нових функціональних груп з зовсім іншими полярності-ними властивостями. Після реакції фермент і субстрат як би Отта-кивають один від одного, і фермент знову готовий вступити у взаємо-дія з іншою молекулою субстрату. Хімічно змінений субстрат отщепляет продукт реакції.
Таким чином, специфічність ферменту обумовлюється його конфігурацією, будовою і електричними властивостями активної групи ферменту.
Інактивація. Упроцесі протікання каталітичної реакції фермент поступово руйнується і втрачає свою активність. Це явище отримало назву інактивації. Досвід показує: чим більшою активністю володіє фермент, тим він сильніший раз-Руша в процесі каталізу. Цим властивістю ферменти сущест-венно відрізняються від неорганічних каталізаторів, які, як уже зазначалося, залишаються без зміни в продуктах реакції.
Будова ферментів. У порівнянні з неорганічними каталізу-торами ферменти мають значно більш складну будову. Кожен фермент містить білок, яким і обумовлена висока специфічність біологічних каталізаторів. За своєю будовою ферменти підрозділяються на два великі класи: однокомпонентні і двокомпонентні. До однокомпонентних відносяться фермен-ти, що складаються тільки з білкових тіл, які володіють катали-тическими властивостями. У цих ферментів роль активних груп ви-полняют певні хімічні угруповання, що входять до складу білкової молекули і отримали назву активних центрів.
В даний час понад 100 відомих однокомпонентних фер-ментів по
лучено в кристалічному вигляді.
До двокомпонентним відносяться такі ферменти, які скла-ят з білкової і небілкової частини, званої простетичної групою. Було запропоновано активну простетичної групу називаються вать агон, а білковий носій - ФЕРОН чи інакше апофермент. Дослідження показали, що білкова частина двокомпонентного ферменту (ФЕРОН) робить вирішальний вплив на специфічність його дії. Разом з тим з'єднання активної групи з білком призводить до величезного зростанню її каталітичної активності.
Було також показано, що міцність зв'язку агона і ферона у раз-них ферментів різна. У деяких ферментів, наприклад дегідрогеназ, які каталізують окислення різних субстратів пу-тем відібрання водню (дегидрирование), цей зв'язок є неміцний-ної. Такі ферменти легко дисоціюють і розпадаються на агон і ФЕРОН. За пропозицією видатного французького біохіміка Г. Бертрана, агони, легко відділяються від білкової частини фермен-та, зазвичай називають, коферментами.
Як приклад двокомпонентного ферменту можна назвати фермент піруватдекарбоксилази, який розщеплює пировиноградную кислоту на оцтовий альдегід і оксид вуглецю (IV):
Хімічна природа активної групи піруватдекарбоксилази в даний час повністю з'ясована. Вона являє собою з'єднання молекули вітаміну B1 і двох залишків фосфорної киць-лоти. Піруватдекарбоксилази є прикладом ферменту, ак-тивна група якого містить вітамін. Як показали дослід-вання, вітаміни є невід'ємною складовою частиною цілого ряду найважливіших ферментів (каталаза, пероксидаза та ін.).
Вплив зовнішніх умов. За своєю природою ферменти значи-тельно більш чутливі до зміни зовнішніх умов, ніж неорганічні каталізатори. Зокрема, ферменти «працюють» в значно вужчому діапазоні температур. Температурний оптимум більшості рослинних ферментів 313-333 К, живіт-них ферментів 313-323 К. Якщо температура перевищить ці преде-ли, активність ферменту дуже швидко падає, а при 343-353 К відбувається їх необоротне руйнування, обумовлене денатура-цією білка. Лише дуже небагато ферменти здатні в визначений-них умовах витримати нагрівання до 373 К без втрати актив-ності.
Неорганічні каталізатори, як показує досвід, можуть від-особисто працювати і при більш високих температурах - до неяк-ких сотень градусів.
На відміну від неорганічних каталізаторів ферменти проявля-ють свою активність в строго визначеному діапазоні значень рН середовища. У табл. 2.1 наведені значення рН, при яких раз-особисті ферменти проявляють свою максимальну активність.
Як видно з цієї таблиці, діапазон значень рН вельми ши-рок для активності різних ферментів. Вплив рН на активність ферментів пояснюється зміною стану іонізації не тільки ферменту і субстрату в окремо, але і фермент - субстратного комплексу.
Різні ферменти мають різний оптимум pH.
Ферменти різних с / г культур мають різні оптимальні значення pH:
У рису 4,5 У пшениці 6,0 У загальному вигляді: Vкат. = F (T, pH) Кінетика біохімічних реакцій описується рівнянням Міхаеліса - Ментен. Міхаеліс і Ментен вивчали швидкість реакції гідролізу АТФ міозином. Білки актин, міозин і АТФ відіграють визначальну роль в процесі м'язових скорочень. АТФ гідроліз → АДФ + Ф + Е Е - ця енергія використовується при м'язових скороченнях. АТФ - субстрат (реагент); де # 965; 0 - початкова швидкість реакції; # 965; 0max - теоретично певна початкова швидкість реакції при max концентрації субстрату; S0 - початкова концентрація субстрату; KS - така концентрація субстрату, при якій: # 965; 0 = ½ # 965; 0max 1) при малих S0 залежність # 965; 0 = f (S0) лінійна (підпорядковується рівнянню реакції # 921; - го порядку); 2) при S0 »KS реакція нульового порядку концентрацією субстрату, т. Е. Початкова швидкість не залежить від концентрації субстрату, настає насичення.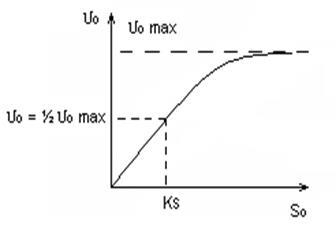
Схожі статті