2. Етапи розвитку біотехнології
У розвитку біотехнології виділяють наступні періоди:
Останній спеціально відділяється від попереднього, так як біотехнологи вже можуть створювати і використовувати у виробництві неприродні організми, отримані генно-інженерними методами.
1) Емпірична біотехнологія невіддільна від цивілізації, переважно як сфера виробництва (з найдавніших часів - приготування тіста, отримання молочнокислих продуктів, сиро, виноробство, пивоваріння, ферментація тютюну і чаю, вироблення шкір і обробка рослинних волокон). Протягом тисячоліть людина використовувала в своїх цілях ферментативні процеси, не маючи поняття ні про ферментах, ні про клітинах з їх видовою специфічністю і, тим більше, генетичним апаратом. Причому прогрес точних наук довгий час не впливав на технологічні прийоми, які використовуються в емпіричної біотехнології.
2) Швидкий розвиток біотехнології як наукової дисципліни з середини XIX ст. було ініційовано роботами Л. Пастера (1822 - 1895).
Саме Л.Пастер ввів поняття біооб'єкту, не вдаючись, втім, до такого терміну, довів «живу природу» шумувань: кожне яке здійснювалося в виробничих умовах бродіння (спиртове, уксусно-, молочнокисле і т.д.) викликається своїм мікроорганізмом, а зрив виробничого процесу обумовлений недотриманням чистоти культури мікроорганізму, що є в даному випадку біооб'єкти.
Практичне значення цих досліджень Л. Пастера зводиться до вимоги підтримки чистоти культури, тобто до проведення виробничого процесу з індивідуальним, які мають точні характеристики біооб'єктів.
Пізніше, приступивши до робіт в області медицини, Л. Пастер виходив зі своєї концепції про причини заразних хвороб, зводячи її в кожному випадку до конкретного, певного мікроорганізму. Хоча техніка того часу не дозволяла побачити збудника інфекції, як, наприклад, в разі вірусу сказу, однак Л.Пастер вважав, що «ми його не бачимо, але ми їм управляємо». Цілеспрямований вплив на збудника інфекції (з метою ослаблення його патогенності) дозволяє отримувати вакцини.
Ослаблений патоген і тварина, в організм якого він введений, можуть розглядатися як своєрідний біооб'єкт, а одержувана вакцина - як біотехнологічний препарат. Л. Пастер створив строго наукові основи отримання вакцин, тоді як чудові досягнення Е. Дженнер в боротьбі з віспою були результатом освоєння емпіричного досвіду індійської медицини.
3) Сучасна біотехнологія, заснована на досягненнях молекулярної біології, молекулярної генетики та біоорганічної хімії (на практичному втіленні цих досягнень), зросла з біотехнології Л. Пастера і, будучи також строго наукової, відрізняється від останньої насамперед тим, що здатна створювати і використовувати в виробництві неприродні біооб'єкти, що відбивається як на виробничому процесі в цілому, так і на властивостях нових біотехнологічних продуктів.
Говорячи про біотехнології, не можна не згадати публікацію в 1953 р першого повідомлення про двуспиральной структурі ДНК, що став основоположним для виникнення зазначених фундаментальних дисциплін, досягнення яких реалізуються в сучасній біотехнології.
В результаті серій публікацій в 1960-х рр. в літературу були впроваджені принципово важливі для біотехнолога поняття «оперон» і «структурний ген».
У 1980 р Верховний суд США визнав, що генно-інженерні мікроорганізми можуть бути запатентовані, а розвиток біотехнологічних методів отримало юридичний статус.
В даний час інтенсивно зростає кількість таких успішно застосовуються в медицині біотехнологічних продуктів, як рекомбінантні білки, вторинні метаболіти мікроорганізмів і рослин, а також напівсинтетичних лікарських агентів, які є продуктами одночасно біо- і оргсинтеза.
3. Історія розвитку біотехнології (дати, події).
1917 - введено термін біотехнологія;
- проведений в промисловому масштабі пеніцилін;
- показано, що генетичний матеріал являє собою ДНК;
1953 - встановлено структуру інсуліну, розшифрована структура ДНК;
1961 - засновано журнал «Biotechnology and Bioengineering»;
1961-1966 - розшифровано генетичний код, який опинився універсальним для всіх організмів;
1953 - 1976 - розшифрована структура ДНК, її функції в збереженні і передачі організмом спадкової інформації, здатність ДНК організовуватися в гени;
1963 - здійснено синтез біополімерів за встановленою структурою;
1970 - виділена перша рестрикционная ендонуклеаза;
- здійснений синтез ДНК;
1972 - синтезований повнорозмірний ген транспортної РНК;
1975 - отримані моноклональні антитіла;
1976 - розроблені методи визначення нуклеотидної послідовності ДНК;
1978 - фірма «Genentech» випустила людський інсулін, отриманий за допомогою Е. соli;
- синтезовані фрагменти нуклеїнових кислот;
- дозволена до застосування в Європі перша вакцина для тварин, отримана за технологією рекомбінантних ДНК;
1983 - гібридні Ti - плазміди застосовані для трансформації рослин;
4. Нові технології в біоформацевтіке
Сьогодні людство зовсім справедливо вважає, що біотехнологічні науки займають пріоритет в області сучасних високих технологій. Сіквенірованіе геномів і валідація нових мішеней для дії лікарських сполук є одним з перспективних напрямків сучасної фармакології. З огляду на, що з'явилися нові принципові можливості для сіквенірованія, постає питання про генетичну паспортизацію населення, коли кожному буде виданий його генетичний паспорт, і людина буде вирішувати проблеми свого здоров'я. Найважливішим досягненням минулого століття є стовбурові клітини, що стало можливим завдяки розвитку всієї ембріології і цитології. Це дозволило підійти до розробки шляхів створення штучних органів, отримувати нові речовини, що специфічно впливають на органи-мішені.
На сучасному етапі розвитку біотехнології велика увага приділяється розробці підходів до створення нових процесів у медичній біотехнології. Це різні методи модифікації мікроорганізмів, рослин і тварин, в т.ч. культивування рослинних клітин як джерела отримання нових речовин; конструювання молекул, нанотехнології, комп'ютерне моделювання, биокаталитических трансформація речовин і т.д.
Так, наприклад, існують численні розробки лікарських препаратів, створених на основі морських організмів. Використання морських природних сполук як основи ліків - дуже перспективний шлях створення нових фармацевтичних препаратів, особливо методами біотехнології. Колекція морських мікроорганізмів ТІБОХ, з яких можна продукувати біологічно-активні сполуки, містить 800 штамів бактерій, актиноміцетів і грибів. Ці штами можна культивувати, що важливо для вирішення проблеми збереження біологічної рівноваги.
Таким чином, в отриманні лікарських препаратів, вироблених біотехнологічним способом, можна виділити як би два пула - нові сполуки, одержувані за допомогою біотехнологічних процесів, комбінаторної хімії, і нові мішені, які ідентифікуються в процесі вивчення геномів. Це дає можливість відбирати молекули, що володіють новими біологічними і фізіологічними властивостями, які і будуть виконувати роль ліків.
Перш за все, звернемося до медичної галузі біотехнології. Розглядаючи різні класи сполук, що використовуються в клінічній практиці, і одержувані методами біотехнології, в першу чергу, необхідно назвати антибіотики - найбільший клас фармацевтичних сполук, синтез яких здійснюється мікробними клітинами. До цього ж класу відносяться протигрибкові агенти, протипухлинні ліки і алкалоїди. Виробництво антибіотиків обчислюється тисячами тонн. Пеніциліни, як відомо, були виділені при вирощуванні грибів роду Penicillium. У 1945 р з проби морської води була виділена цвіль Cephalosporium acremonium, що синтезує кілька антибіотиків; один з них, цефалоспорин С, виявився особливо ефективний проти стійких до пеніциліну грампозитивних бактерій.
З кількох тисяч відкритих антибіотиків левова частка належить актиноміцетам. Серед актиноміцетів найбільший внесок вносить рід Streptomyces, один тільки вигляд Streptomyces griseus синтезує більше п'ятдесяти антибіотиків. Починаючи з середини 1960-х рр. у зв'язку із збільшеною складністю виділення ефективних антибіотиків і поширенням стійкості до найбільш широко застосовуваним з'єднанням у великої кількості патогенних бактерій дослідники перейшли від пошуку нових антибіотиків до модифікації структури вже наявних. Вони прагнули підвищити ефективність антибіотиків, знайти захист від інактивації ферментами стійких бактерій і поліпшити фармакологічні властивості препаратів. Антибіотики виробляються в результаті спільної дії продуктів 10-30 генів, тому практично неможливо виявити окремі спонтанні мутації, які могли б підвищити вихід антибіотика з декількох міліграмів на літр в штамі дикого типу до 20 г / л і більше. Такі високопродуктивні штами Penicillium chrysogenum або Streptomyces auerofaclens (продуценти пеніциліну або тетрацикліну) були отримані в результаті послідовних циклів мутагенезу та селекції. Певні мутанти, так звані ідіотрофи, здатні синтезувати тільки половину молекули антибіотика, а середовище має бути збагачена інший її половиною. Така форма мутаційного біосинтезу привела до відкриття нових похідних антибіотиків.
Число протипухлинних речовин мікробного походження досить обмежено. Блеомицин, виділений з культур Streptomyces verticilliis, являє собою глікопептид, який діє, розриваючи ДНК пухлинних клітин і порушуючи реплікацію ДНК і РНК. Інша група протипухлинних агентів створена на основі комбінації аміноглікозидний одиниці і молекули антрацикліну. Недоліком обох сполук є їх потенційна небезпека для серця.
Антибіотики використовуються грибами та актиноміцетами в конкурентній боротьбі в природному середовищі існування. Людина застосував ці сполуки для терапії інфекційних і онкологічних захворювань. Це стало своєрідним поштовхом еволюційних перетворень в мікробної середовищі, стали виникати стійкі штами бактерій. У зв'язку з цим знову виникла проблема створення нового покоління більш ефективних антибіотиків. В даний час протокол лікування інфекційної і хірургічної патології обов'язково включає антибіотики. Але, маючи незаперечні переваги, антибіотики надають на організм людини і негативний вплив: порушується мікрофлора шлунково-кишкового тракту, можливі ускладнення у функціонуванні нирок та печінки, пригнічується робота імунної системи. Тому сучасні схеми лікування є комплексними і спрямовані на підтримку адаптаційних можливостей людини.
Новим напрямком у медицині є використання ферментних препаратів типу «контейнер», виготовлення яких стало можливим появі та удосконаленню методів іммобілізації речовин. Ці препарати є мікросфери з більш-менш твердою і проникною оболонкою. Призначення цих лікарських препаратів різне.
Слід враховувати, що мікрокапсули, що вводяться в кров, можуть забивати кровоносні судини і, отже, бути причиною утворення тромбів. Однак ефективність мікрокапсул при використанні їх у вигляді колонок для діалізу в апараті «штучна нирка» безсумнівна. При цьому обсяг апаратів і, відповідно, кількість необхідних і дуже дорогих розчинів різко скорочується.
У ряді випадків використовуються високомолекулярні сполуки, розчинні в певних умовах і зберігають високу міцність оболонок в інших. Так поводиться ацетілфталілцеллюлоза, мікрокапсули з якої інтактні в шлунковому соку і розчиняються в кишечнику, звільняючи вміст. Зараз інтенсивно досліджуються властивості мікрокапсул, стінка яких складається з оболонок еритроцитів. Вміст еритроцитів видаляється, а «тінь» заповнюється ферментом. Серйозні успіхи досягнуті при лікуванні аспарагин-залежних пухлин препаратами аспарагинази в оболонках еритроцитів. Використовуються оболонки і інших клітин. Так, описані лікарські препарати, включені в оболонки макрофагів. Останні мають тенденцію накопичуватися в осередках запалень, а отже, можуть транспортувати туди як низько-, так і високомолекулярний лікарський препарат. Суттєвою позитивною стороною «тіней» клітин в якості носія є їх повна сумісність з організмом пацієнта, оскільки цей носій готують на основі клітин, виділених з крові пацієнта, і повертають їх йому ж з новим вмістом.
Іншим важливим класом лікарських сполук є генно інженерні ферменти, що відповідають ферментам людини. У порівнянні з ферментами, які отримують з природної сировини, вони мають ряд переваг: низькою антигенностью, високу специфічність фармакологічного дії, відсутністю контамінують інфекційних агентів. Генно-інженерні технології дозволяють легко збільшувати промислове виробництво ферментів. Ферменти знаходять все більш широке застосування як біокаталізатори в фармацевтичному виробництві.
Спрямована модифікація за допомогою методів генної інженерії відкриває можливості трансформації структури ферментів таким чином, що вони набувають якісно нові властивості. Так, особливий інтерес у світі зараз представляє можливість переходу від пеніцилінів до цефалоспоринів за допомогою генно-інженерного ферменту експандази, завдяки чому уніфікується біотехнологічна частина отримання антибіотиків. Далі за допомогою інших биокаталитических процесів і суміщення їх з хімічними можна виробляти клас нових антибіотиків для боротьби з інфекціями.
Біокаталітичні підходи відкривають велике поле для різних варіантів побудови нових фармацевтичних процесів. Зокрема, використання генно-інженерних ферментів дозволяє отримати оптично активні ізомери сполук, які складають більше 70% всіх ліків. При цьому період окупності биокаталитических процесів значно коротше в порівнянні з хімічним синтезом, а за енерговитратами і капіталовкладенням вони теж мають великі перспективи. Техноінженерние ферменти широко використовуються для створення діагностичних тест-систем в біохімічному, иммуноферментном і ДНК-аналізах.
Біотехнологія - це виробниче використання біологічних агентів або їх систем для отримання цінних продуктів і здійснення процесів різного призначення. В цілому, біотехнологія являє собою систему прийомів, що дозволяють отримувати промисловим способом цінні продукти за рахунок використання процесів життєдіяльності живих організмів.
У фармацевтичній промисловості біотехнології застосовуються для виробництва антибіотиків, імунобіологічних препаратів, генно-інженерних лікувально-профілактичних препаратів, для виробництва ензимів, біологічно активних речовин та інших медичних препаратів. Важливим напрямком біотехнологій в медицині є використання біотехнологій для реконструкції тканин і органів людини з використанням стовбурових клітин.
Одним з перспективних напрямків є використання нанотехнологій в медичних цілях, створення нових носіїв і коштів цільової доставки лікарських препаратів.
Нові біологічні технології використовуються в діагностиці та лікуванні серцево-судинних, онкологічних, алергічних і ендокринних захворюваннях.
Щорічний приріст світового ринку біотехнологічної продукції становить 7-10%. Вже сьогодні використання біотехнологічних розробок дозволяє вирішувати багато проблем діагностики та лікування особливо небезпечних захворювань, недостатнього або незбалансованого харчування, підвищення якості питної води, знезараження небезпечних для людини і навколишнього середовища відходів.
Характерний зростання числа спеціалізованих періодичних видань з біотехнології, що випускаються в різних країнах, міжнародних і регіональних біотехнологічних конгресів і конференцій.
4. Бейлі Дж. Олліс Д. Основи біохімічної інженерії. У 2-х томах. М. Світ, 1989 г.
5. Біотехнологія: Навчальний посібник для вузів / Під ред. Н.С. Єгорова, В.Д. Самуілова.- М. Вища школа, 1987.
8. Матвєєв В.Е. Наукові основи мікробіологічної технології. М. Агропромиздат, 1985 г. 224 с.
Біотехнологія - новий напрямок у фармацевтичній технології
Інформація про роботу «Біотехнологія - новий напрямок у фармацевтичній технології»
Розділ: Медицина, здоров'я
Кількість знаків з пробілами: 26379
Кількість таблиць: 0
Кількість зображень: 0
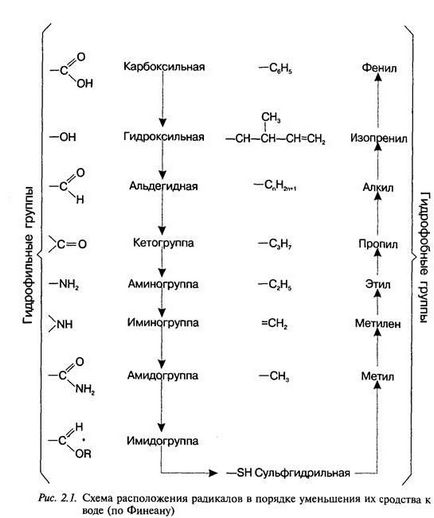
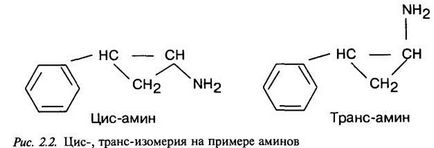
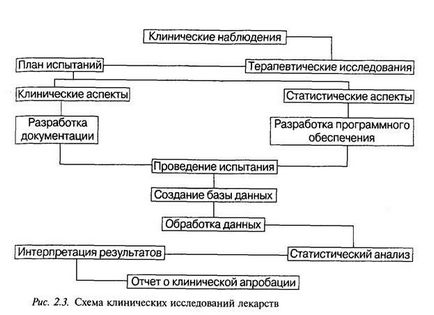
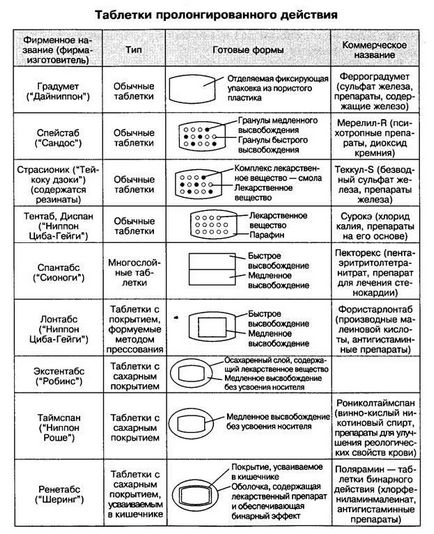
виробництва нових лікарських препаратів. Такий підхід до цієї проблеми є якісно новим у фармацевтичній практиці і, оче-видно, дозволить розкрити нові можливості в складному процесі створення і використання лікарських препаратів. 2. Шляхи вдосконалення традиційних ліків При розробці нових лікарських засобів з уже відомим дією робляться спроби.
за допомогою біотехнологічних процесів, комбінаторної хімії, і нові мішені, які ідентифікуються в процесі вивчення геномів. Це дає можливість відбирати молекули, що володіють новими біологічними і фізіологічними властивостями, які і будуть виконувати роль ліків. Перш за все, звернемося до медичної галузі біотехнології. Розглядаючи різні класи сполук, що використовуються в.