Електрохімічні пристрої і процеси
Так як окислювально-відновні реакції супроводжуються переносом заряду, то їх можна здійснювати дією електричного струму, і навпаки, - отримувати електричний струм за рахунок їх протікання. У відповідних процесах і пристроях використовуються електроди і електродні потенціали.
Поняття про електродному потенціал.
Якщо металеву пластинку опустити в воду або розчин, що містить іони цього металу, то на кордоні розділу метал-розчин за рахунок процесів розчинення-осадження металу виникає різниця або стрибок потенціалу, який залежить від природи металу, концентрації розчину, а також від температури. Цей стрибок називається електродним потенціалом даного металу. Зазначене рівновагу виражається рівнянням, що враховує гидратацию іона:
в розчині на металі
Потенціал, який відповідає цьому рівноваги, називається рівноважним електродним потенціалом.
Значення j можна визначити по абсолютній величині. Тому потенціали всіх електродів визначають по відношенню до стандартного водневого напівелементах (електрода) (рис. 7.1), потенціал якого приймають рівним нулю: j про 298 (2Н + ® Н2) = 0. Стандартний водневий електрод складається з посудини з 1 н. розчином кислоти, в яку опущено платиновий електрод, контактує з газоподібним воднем. знаходяться під тиском Р = 101,3 кПа.
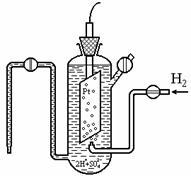
Мал. 7.1. Стандартний водневий електрод
На електроді встановлюється рівновага 2Н + р + 2? Н2 (г). Нульове значення j про для цього електрода визначається і тим, що DG 0 f (Н +) = DG 0 f (Н2) = 0. Платина використовується внаслідок її інертності, а також тому, що вона є каталізатором перенесення електрона (процес встановлення рівноваги прискорюється , але сам стан рівноваги, тобто функції DН, DU, DG, DS, залишається незмінними при постійній температурі).
Потенціали, певні щодо стандартного електрода в стандартних умовах (тобто j про 298) табульовані. Для металів за хімічними даними (Н. Бекетовим), а потім шляхом вимірювання j про 298 встановлено ряд активності металів, який в даний час має назаваніем електрохімічний ряд напруги металів (табл.12.1).
Стандартні електродні потенціали j 0 деяких металів
Електродний потенціал, який вимірюється при стандартних умовах
(Т = 298К; [Mе n +] = 1 моль / л) щодо стандартного водневого електрода, називається стандартним електродним потенціалом металу і позначається j 0. Стандартний електродний потенціал є кількісною характеристикою хімічної активності металу, тобто його здатності віддавати свої валентні електрони і переходити в розчин у вигляді іонів.
Основні властивості ряду напруги.
Чим менше величина j, тим сильніше виражена відновна активність металу.
Якщо умови відрізняються від стандартних, то для розрахунку електродного потенціалу використовується формула Нернста:
де j 0 - стандартний електродний потенціал металу,
n - число електронів, що беруть участь в процесі,
F - постійна Фарадея (96500 Кл / моль),
R - універсальна газова постійна (8,31 Дж · моль - 1 · К - 1),
Т - абсолютна температура (К).
Якщо в наведеному рівнянні замінити постійні числовими значеннями, то воно прийме наступний вигляд:
З формули Нернста видно, що при стандартній концентрації катіонів, що дорівнює 1М φ = j 0. тобто рівноважний електродний потенціал металу дорівнює його стандартному потенціалу.