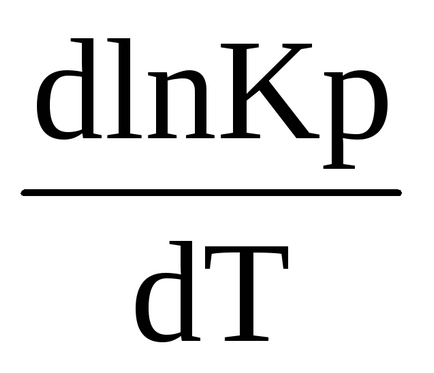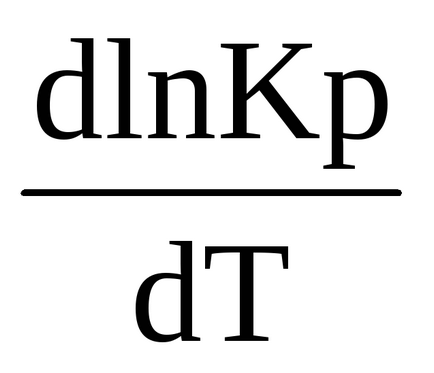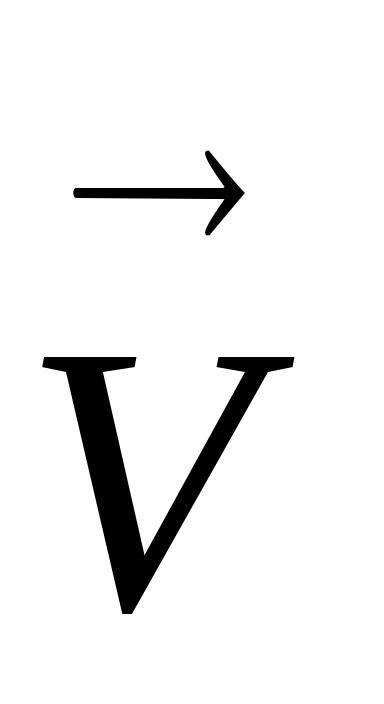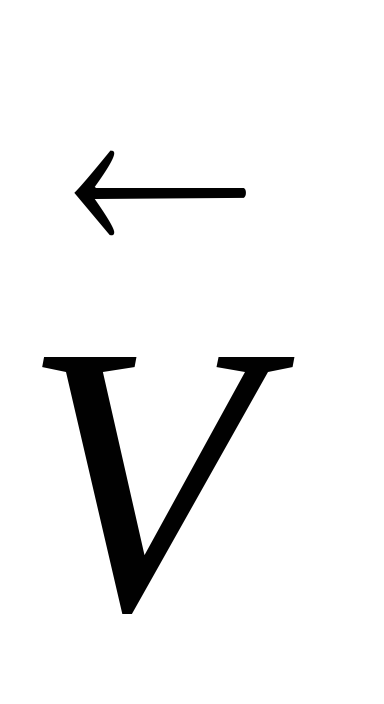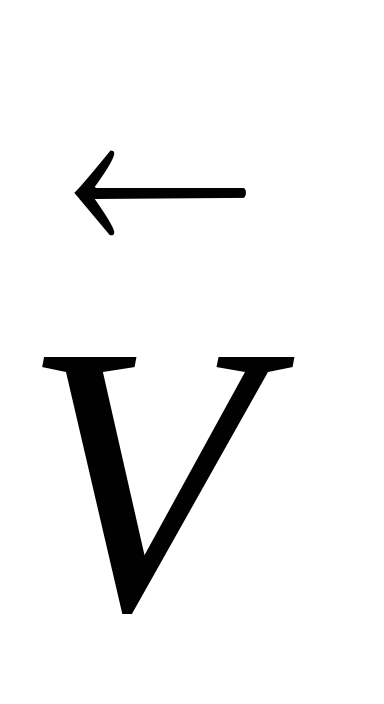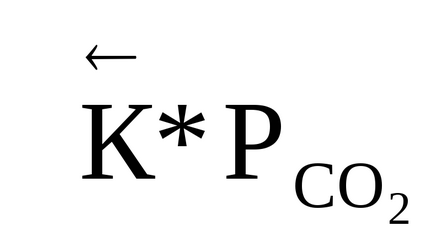0 (т) <0, в правой части выражения (1.90) R> 0, T> 0, отже перша похідна логарифма константи рівноваги по температурі негативна
<0, т.е. ln Kp (и сама константа Кр) являются убывающими функциями температуры. При увеличении температуры константа химического равновесия (Кр) уменьшается и что согласно закону действующих масс (2.27), (2.28)соответствует смещению химического равновесия в сторону обратной (эндотермической) реакции. Именно в этом проявляется противодействие системы оказанному воздействию.
Для ендотермічного процесу Δr Н 0 (т)> 0 похідна логарифма константи рівноваги по температурі позитивна (
> 0), тема чином ln Kp і Кр є зростаючими функціями температури, тобто відповідно до закону діючих мас при збільшенні температури рівновага зміщується в бік прямої (ендотермічної реакції). Однак треба пам'ятати, що швидкість як изотермического так і ендотермічного процесів при підвищенні температури зростає, а при зниженні знижується, але зміна швидкостей
і
при зміні температури неоднаково, тому, варіюючи температуру, можна зміщувати рівноваги в заданому напрямку. Зсув рівноваги може бути викликано зміною концентрації одного з компонентів: додаванням речовини в рівноважну систему або виведенням з системи.
За принципом Ле Шательє при зміні концентрації одного з учасників реакції рівновагу зміщується в бік компенсуючу зміна, тобто при збільшенні концентрації одного з вихідних речовин - в праву сторону, а при збільшенні концентрації одне з продуктів реакції - в ліву. Якщо в оборотної реакції беруть участь газоподібні речовини, то при зміні тиску, однаково і одночасно змінюються всі їх концентрації. Змінюються і швидкості процесів, а отже, може статися і зміщення хімічної рівноваги. Так, наприклад, при збільшенні тиску (в порівнянні з рівноважним) на систему СаСО3 (К)
СО (к) + СО2 (г) зростає швидкість зворотної реакції
=
що призведе до зміщення рівноваги в ліву сторону. При зниженні тиску на тугіше систему швидкість зворотної реакції зменшується, і рівновагу зміщується в праву сторону. При збільшенні тиску на систему 2HCl
H2 + Cl2. що знаходиться в стані рівноваги, зміщення рівноваги не відбудеться, тому що обидві швидкості
і
зростуть однаково.
Для системи 4HCl + О2
2Cl2 + 2Н2 О (г) збільшення тиску призведе до збільшення швидкості прямої реакції і зміщення рівноваги вправо.
І так, відповідно до принципу Ле Шательє при підвищенні тиску рівновагу зміщується в бік утворення меншої кількості молей газоподібних речовин в газовій суміші і відповідно в бік зменшення тиску в системі.
І навпаки, при зовнішньому впливі, що викликає зниження тиску, рівновага зміщується в бік утворення більшої кількості молей газоподібних речовин, що викличе збільшення тиску в системі і буде протидіяти зробленому впливу.
Принцип Ле Шательє має велике практичне значення. На його основі можна підібрати такі умови здійснення хімічної взаємодії, які забезпечать максимальний вихід продуктів реакції.
Схожі статті