Параметри речовини в будь-якому стані пов'язані один з одним рівнянням стану, вид якого в більшості випадків невідомий. Лише для газів, частки яких досить далекі один від одного і майже не взаємодіють, таке рівняння відомо порівняно точно.
Розглянемо газ, що знаходиться в деякому замкнутому просторі (рис. 1.1), тобто параметри якого (температура, тиск, щільність) однакові по всьому об'єму і незмінні. Така система називається рівноважної. Якщо повільно зменшувати обсяг системи, підтримуючи при цьому постійної її температуру, можна побачити, що тиск газу в системі зростає, причому якщо позначити початкові значення тиску і об'єму як P0 і V0. а кінцеві - як P1 і V1. то можна зробити висновок, що твір тиску і обсягу газу є постійна величина для будь-якої точки процесу. Тобто P0 V0 = P1 V1 = const при T = const.
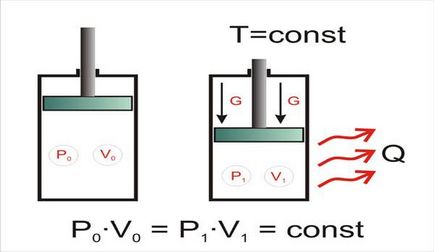
Мал. 1.1. ізотермічне стиснення
Це співвідношення носить назву закону Бойля-Маріотта і формулюється так: твір обсягу даної маси газу на його тиск є величина постійна при незмінній температурі.
Процес, що протікає при постійній температурі, називається ізотермічним. Реальний процес стиснення газу, наприклад, в компресорі, не є ізотермічним - зменшення обсягу і збільшення тиску супроводжується зростанням температури. Однак, якщо стиснений газ охолодити до температури, яку він мав до стиснення, можна буде побачити, що для початкових і кінцевих значень обсягу і тиску закону Бойля-Маріотта дотримується.
Якщо зобразити ізотермічний процес стиснення газу у вигляді графіка, на одній осі якого буде відраховуватися обсяг, а на іншій - тиск (так звана pV-діаграма - рис. 1.2), то прояв закону Бойля-Маріотта полягає в тому, що точки цього графіка представляють собою безліч вершин прямокутників дорівнює площі:
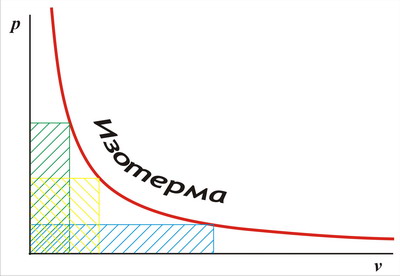
Мал. 1.2. PV-діаграма