Тема - 7: Розчини як фізико - хімічні системи. Насичені і ненасичені розчини. Концентрація речовин в розчині.
· Теорію електролітичноїдисоціації Аррениуса.
· Гідроліз солей і електроліз розплавів і розчинів солей.
· Записувати рівняння реакцій іонного обміну
Визначати кислотність розчинів кислотно - основними індикаторами.
· Складати повні і скорочені іонні рівняння гідролізу солей.
· Передбачати реакцію середовища в розчинах солей.
· Вирішувати завдання на концентрацію розчинів.
7.1. Розчинність речовин.
При розчиненні в воді твердих тіл спочатку відбувається їх дроблення до молекул або іонів, а потім дифузія цих частинок за об'ємом розчину.
Процес розчинення твердої речовини можна прискорити, якщо подрібнити його і перетворити в порошок. Дифузію, яка відбувається в розчині, зазвичай прискорюють перемішуванням розчину (рис. 15). Якщо помістити розчиняється речовина на поверхні води, то так як розчин має велику щільність, він буде стікати вниз, на дно посудини, а на його місце потраплятимуть нові порції води.
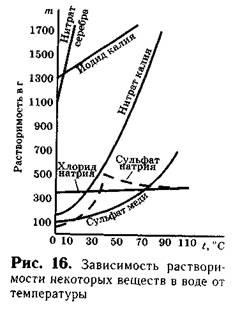
Відомо, що розчинність більшості речовин небезмежна. Так, при звичайних умовах в 100 г води може розчинитися близько 36 г кухонної солі, 40 г калійної селітри, 200 г цукру і т. Д. Якщо ми розчинний, наприклад, 36 г хлориду натрію в 100 г води при 20 ° С, то більше кухонна сіль в цьому розчині розчинятися не буде.
Розчин, в якому дана речовина при певній температурі більше не розчиняється, називають насиченим. Нерастворившаяся сіль буде перебувати на дні посудини з насиченим розчином.
Розчин, в якому дана речовина ще розчиняється при певній температурі, називають ненасиченим.
Масу речовини, що утворить насичений розчин в 100 г розчинника при даній температурі, називають розчинністю цієї речовини або коефіцієнтом розчинності.
За розчинності речовини сильно розрізняються. Розчинність деяких речовин дуже мала. Так, розчинність сульфату барію BaS04 в 100 г води дорівнює 0,00023 г, а хлориду срібла 0,00015 г. Про такі речовини говорять, що вони практично нерозчинні. Якщо розчинність речовини більше 0,1 г, але менше 1 г в 100 г води, то про такі речовини говорять, що вони мало або плохорастворіми. До таких речовин відносять сульфат кальцію CaS04, фосфат магнію Mg3 (P04) 2 та ін. Речовини, розчинність яких більше 1 г в 100 г води, вважають розчинними. Так, розчинність кухонної солі при 20 ° С - близько 40 м Розчинність йодиду калію при цій же температурі дорівнює 144 г. Ці речовини відносяться до розчинним.
При нагріванні розчинів розчинність більшості твердих речовин зростає (рис. 16).
У воді розчиняються і деякі рідини, наприклад, спирт, гліцерин. Інші рідини, такі як бензин, масла, в воді практично не розчиняються.
Гази також розчиняються у воді. Розчинність газів у воді легко виявити, якщо налити в склянку хо холодної води і поставити його в тепле місце. Через деякий час на стінках склянки з'являться бульбашки газу.
Газована вода - розчин вуглекислого газу у воді. Газ в такій воді розчинений при підвищеному тиску. Таким чином, на відміну від твердих тіл розчинність газів з підвищенням температури зменшується, а зі збільшенням тиску - підвищується.
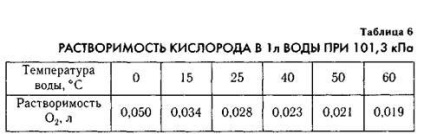
Велике значення має розчинність кисню в воді, від неї залежить розвиток і підтримку життя в водоймах.
З табл. 6 видно, що в холодній воді кисню розчинено більше. Ось чому в холодних водах океану підводне життя багатша, ніж в теплих водах. У холодних водах риби водиться більше. Тому основні промислові зони рибної ловлі знаходяться саме в холодних водах.
1. Речовини, що знаходяться в твердому, рідкому і газоподібному стані, розчиняються у воді, утворюючи розчини.
2. При підвищенні температури розчинність твердих речовин, як правило, підвищується, а газів - зменшується.
7.2. концентрація розчинів
Важливою характеристикою розчинів є концентрація. Під концентрацією розуміють відношення маси або кількості розчиненої речовини до об'єму розчину. Зазвичай в хімії використовують молярну концентрацію.
Молярної концентрацією розчину називають відношення кількості розчиненої речовини до об'єму цього розчину:
CA = n__ (моль / л)
Знаючи кількість розчиненої речовини в тому або іншому обсязі розчину, можна визначити його молярна концентрація.
Таким чином, концентрація і масова частка речовини в розчині - різні поняття. Концентрація характеризує розчин, масова частка - розчинена речовина.

2. Розрахуйте молярну концентрацію розчину, в 300 мл якого розчинено 0,5 моль речовини.
3. Молярна концентрація розчину дорівнює 1,5 моль / л. Яка кількість розчиненої речовини міститься в 200 мл розчину?
4. Визначте масу речовини (Мг = 111 г / моль), що міститься в 200 мл 0,5 М розчину.
5. * Визначте молярну концентрацію 20% -ного розчину речовини (Мг - 40 г / моль), щільність якого р = 1,11 г / мл.
7.3. Електролітична дисоціація речовин
Водні розчини деяких речовин проводять електричний струм. Чи можна зробити висновок, що це пов'язано з якимись особливостями їх будови?
Візьмемо три речовини - цукор, кухонну сіль і дистильовану воду. За допомогою установки, зображеної на рис. 17, перевіримо їх електричну провідність. Досліди показують, що жодне з цих речовин струму не проводить. Потім приготуємо розчини цукру і кухонної солі у воді і визначимо електропровідність водних розчинів речовин. Розчин цукру не проводить електричного струму, а розчин кухонної солі проводить.
Аналогічні досліди з визначення електропровідності безлічі речовин, їх розчинів і розплавів дозволили розділити речовини на дві великі групи - електроліти і неелектролітів.
Речовини, розчини або розплави яких проводять електричний струм, називають електролітами. Речовини, розчини та розплави яких не проводять електричний струм, називаються неелектролітів.
Електролітами є солі, луги та кислоти - речовини з іонними або полярними ковалентними зв'язками. Неелектролітами - цукор, спирт, азот. кисень та інші речовини, що мають ковалентні неполярні або малополярние зв'язку.
Якщо розчин певної речовини проводить електричний струм, це означає, в розчині є заряджені частинки, здатні переміщатися. Без виконання цих умов електрична провідність неможлива. Згадаймо: метали добре проводять електричний струм, тому що в них є вільні електрони.
Іонні сполуки (солі, луги) складаються з іонів, але в твердому вигляді струм не проводять, так як іони не можуть вільно рухатися. Чому ж в розчинах електролітів заряджені частинки отримують можливість переміщатися? Може бути, причина полягає в будові молекул води?
Атоми кисню і водню в молекулі води пов'язані ковалентним полярної зв'язком, загальні електронні пари зміщені в бік більш електронегативного атома кисню. Тому на ньому утворюється частковий негативний заряд (8-), а на атомах водню - частковий позитивний заряд (# 948; +). Таким чином, в молекулі води є два полюси, т. Е. Кожна молекула являє собою диполь.
Молекули води, що знаходяться в постійному тепловому русі, мають значну енергією. При попаданні у воду іонного кристала хлориду натрію молекули води притягуються позитивними кінцями диполів до негативних іонів, а негативними - до позитивних іонів. Кінетичної енергії молекул води досить для того, щоб зруйнувати кристал кухонної солі на окремі іони Na і Сl
Утворилися іони натрію і хлорид-іони вільно переміщаються
в розчині, вони і є переносниками зарядів. Руйнування кристалів кухонної солі відбувається і при їх нагріванні до температури плавлення. Таким чином, в розплаві також з'являються заряджені частинки, здатні вільно переміщатися.
Спрощено процес електролітичноїдисоціації можна записати у вигляді рівняння:
Всі солі дисоціюють на іони металу і іони кислотного залишку, наприклад:
Луги дисоціюють на іони металу і гідроксид іони, наприм
Суми зарядів позитивних і негативних іонів, що утворюються при електролітичноїдисоціації речовини, рівні по абсолютній величині.
Велектролітичні дисоціацію речовин з ковалентним полярної зв'язком розглянемо на прикладі соляної кислоти.
При попаданні у воду полярних молекул хлороводню їх оточують диполі води. Під дією молекул води зв'язок в кожній молекулі хлороводню ще сильніше поляризується, загальна електронна пара повністю зміщується до атома хлору, і утворюються іони водню і хлору. Рівняння дисоціації речовин з полярним ковалентним зв'язком записують так само, як і для речовин з іонним зв'язком.
Вивчення властивостей речовин - один з найважливіших способів пізнання їх будови. Так, за здатністю речовини проводити або не проводити електричний струм в розчинах або розплавах можна висловити припущення про характер хімічного зв'язку в ньому. Для електролітів характерна іонна або ковалентний сильнополярная зв'язок. Процес розпаду електроліту на іони називають електролітичної дисоціацією; в розчині вона обумовлена взаємодією речовини з диполями води, а в розплаві - нагріванням.
3. Напишіть рівняння електролітичноїдисоціації наступних речовин: а) КВг; б) NaF; в) Lil; г) HI.
4. Напишіть і прочитайте рівняння електролітичноїдисоціації кислот: а) НВг; б) H, S03; в) Н3Р04; г) НМп04.
5. Складіть і прочитайте рівняння електролітичноїдисоціації лугів: а) КОН: б) Ва (ОН) 2; в) LiOH; г) Sr (OH) 2.
6. Складіть і прочитайте рівняння електролітичноїдисоціації солей: a) MgCl2; б) Na3P04; в) CuS04; г) Fe (N03) 3.
7.4. властивості іонів
Властивості атомів і утворюються з них іонів розрізняються, що зумовлено їх різною будовою. Щоб переконатися в цьому, розглянемо атоми і іони натрію і хлору.
Іони утворюються в результаті перебудови електронних оболонок атомів натрію і хлору. Електронна оболонка іона натрію схожа на оболонку атома неону, а хлорид-іона - на
електронну оболонку атома аргону (рис. 22). Тому властивості іонів натрію і хлорид-іонів зовсім інші, ніж властивості атомів натрію і хлору. Металевий натрій складається з атомів і іонів натрію, а газоподібний хлор - з молекул, до складу яких входять по два атома хлору. Відомо, що натрій - активний метал, а хлор - активний неметалл. Ці речовини істотно відрізняються від хлориду натрію (кухонна сіль), який складається з іонів натрію і хлорид-іонів. Так, хлорид нанатрія і хлорид-іонів. Так, хлорид натрію на відміну від хлору безбарвний, позбавлений запаху і неядовіт. На відміну від натрію хлорид натрію з водою не взаємодіє і водень з води не витісняє. Якщо металевий натрій і газоподібний хлор небезпечні для організму людини, то іони Na + і СГ необхідні для нормальної життєдіяльності. Тому кухонну сіль додають в їжу.
Іони натрію і хлорид-іони в розчині безбарвні. Однак існують і пофарбовані іони. Так, іони Сu2 + в розчині мають блакитний колір, а іони кислотного залишку марганцевої кислоти МnO4- - малиново-фіолетовий. (Калійна сіль цієї кислоти - перманганат калію КМn04 широко застосовується в медицині під назвою «марганцівка». Розчин пер-манганата калію забарвлений за рахунок іонів Мn04.)
Речовинами, що містять забарвлені іони, можна скористатися для доказу того, що іони - заряджені частинки. Проведемо такий досвід. Змочивши фільтрувальну папір розчином нітрату калію, який, як відомо, проводить електричний струм. Подсоединим змочену розчином електроліту фільтрувальну папір до джерела постійного струму і помістимо на неї кристалики хлориду міді (II) СuС12 (рис. 23). Іони міді пофарбовані, а іони калію, хлорид - і нітрат-іони безбарвні. Через деякий час від кристалів солі до негативно зарядженого електроду потягнуться пофарбовані язички. Значить, іони міді Сі зміщуються в бік негативно зарядженого електрода - катода. Можна, можливо
припустити, що в цю ж сторону рухаються і іони калію К, а хлорид-іони Сl - і нітрат-іони NO3- переміщаються в бік позитивно зарядженого електрода - анода.
Іони, що переміщаються в електричному полі до катода, називаються катіони.
Іони, що рухаються в електричному полі до анода, називають аніони.
Аніонами є гідроксид-іон ОН, а також іони кислотних залишків N03-, SO42-, Сl - і ін.
Як ми переконалися, іони - заряджені частинки, а тому взаємодіють між собою за допомогою кулонівських сил. Завдяки цим же силам іони можуть переміщатися в розчинах під дією постійного електричного струму. А тепер згадаємо, що молекули води є диполі (див. Рис. 18), тобто позитивний і негативний заряди в молекулі води роз'єднані і знаходяться в різних її частинах. Тому іони можуть взаємодіяти з цими зарядами і утворювати сполуки.
Процес утворення сполуки іонів з молекулами води називають гідратацією. Утворені при цьому речовини називають гідратами.
Тверді кристалічні гідрати, що утворюються при повільному випаровуванні води з розчинів, називають кристалогідрати.
Кристалогідрати, як правило, мають постійний склад. Так, кристаллогидрат - мідний купорос - утримує п'ять молекул води CuS04-5H20. Приклади інших кристаллогидратов: FeS04-7H20; Na2CO3-10H2O.
Процес гідратації відбувається завдяки руху іонів і полярних молекул води. Сили, що утримують частинки один біля одного, також електричні.
Процес гідратації можна порівняти з утворенням іонних зв'язків, адже сили, які утримують молекули води і іони, - кулонівських. Тому при гідратації відбувається виділення енергії. Розчин повинен нагріватися. І дійсно, при розчиненні кислот, лугів і деяких солей розчин помітно нагрівається. Так, при розчиненні сірчаної кислоти виділяється стільки тепла, що розчин може закипіти. Ось чому в цілях безпеки при розведенні концентрованої сірчаної кислоти слід доливати її невеликими порціями в воду. Щільність сірчаної кислоти більше, ніж у води, тому вона буде опускатися на дно посудини. При цьому нагрівання розчину буде відбуватися більш рівномірно і він не закипить.
Поряд з гідратацією при розчиненні речовин у воді відбуваються, як відомо, їх дроблення і дифузія частинок речовини по всьому об'єму розчину. При протіканні цих процесів розчин повинен охолоджуватися, так як їм відбувається робота з дроблення кристалів. Існують речовини, наприклад нітрати, при розчиненні яких у воді температура розчину помітно знижується. Сумарний тепловий ефект розчинення речовин залежить від величини енергії, що виділяється гідратації і поглинати енергію дроблення. Якщо при гідратації енергії виділяється більше, ніж її витрачається на дроблення речовини, то розчин нагрівається. Якщо ж, навпаки, на дроблення речовини енергії витрачається більше, ніж її виділяється в результаті гідратації, то розчин охолоджується.
1. Властивості атомів і іонів істотно розрізняються. Це зумовлено відмінностями в будові їх електронних оболонок і наявністю зарядів у іонів.
2. Іони, які підлогу дією постійного струму переміщуються до катода, називаються катіонами, а ті, які переміщуються до анода, - аніонами.
3. У процесі розчинення, крім дроблення речовини і дифузії, відбувається також гідратація, тобто взаємодія полярних молекул води з іонами. В результаті цього процесу утворюються гідрати.
4. Тверді гідрати, що включають молекули води в свої кристали, називають кристалогідрату.
5. Тепловий ефект розчинення речовин залежить від величини енергії, що витрачається на дроблення речовини, і енергії, що виділяється внаслідок гідратації.