Слід зауважити, що полярні радикали можуть взаємодіяти з молекулами води, тому вони називаються гідрофільними. Неполярні радикали не взаємодіють з молекулами води, вони називаються гідрофобними.
Існує також біологічна класифікація амінокислот, яка враховує можливість їх синтезу в організмі. Всі амінокислоти поділяються на замінні (можуть синтезуватися в організмі) і незамінні або есенціальні (в організмі не син-тезіруются і повинні надходити з їжею). Деякі основні амінокислоти здатні піддаватися додатковій модифікації вже в складі білкових молекул, в результаті хімічних реакцій, таких як гидроксилирование і метилювання. Наприклад в коллагене міститься гидроксипролин.
Прийнято виділяти чотири рівні структурної організації білкової молекули: первинна, вторинна, третинна і четвертинна структури. Розглянемо особливості кожного з цих рівнів.
Первинною структурою білка називають послідовність чергування амінокислот у поліпептидного ланцюга. Первинна структура кожного білка унікальна і запрограмована генетично.
Первинну структуру білка формують пептидні зв'язки, що утворюються при взаємодії # 945; -карбоксільной групи однієї амінокислоти з # 945; -аминогруппами іншої амінокислоти. Поліпептидний ланцюг складається з регулярно повторюваних ділянок, що утворюють основну ланцюг або пептидний кістяк, і вариабельной частини, що включає в себе характерні бічні ланцюги - радикали амінокислот.
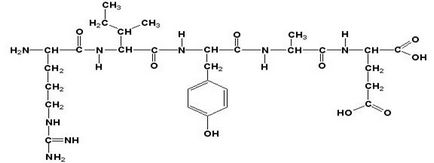
Амінокислотні ланки пептиду (білка) називаються амінокислотними залишками. Амінокислотний залишок, що містить вільну # 945; -аминогруппами, називають N-кінцевим, а залишок, який має вільну # 945; -карбоксільную групу, - С-кінцевим. Структурні формули пептидів записуються і читаються з N-кінця. Все амінокислотні залишки, що входять до складу поліпептиду (крім С-кінцевого), отримують закінчення іл замість ин. Назва даного пептиду - аргінілізолейцілтірозіл-глутамат.
Первинна структура білка, тобто набір і порядок чергування амінокислот визначає його подальші фізико-хімічні та біологічні властивості.
З'ясування амінокислотноїпослідовності білків становить інтерес по ряду причин.
По-перше, зміна послідовності амінокислот в результаті мутації може привести до порушення нормальної функції білка, а отже, до розвитку захворювання. Така важка хвороба, як серповидно-клітинна анемія виникає в результаті заміни однієї-єдиної амінокислоти в одному-єдиному білку.
По-друге, знання амінокислотноїпослідовності важливо для з'ясування молекулярної основи біологічної активності білка.
По-третє, порівняльне вивчення послідовностей амінокислот в білках дозволяє простежити еволюцію на молекулярному рівні.
По-четверте, це необхідно для з'ясування тих принципів, на основі яких з поліпептидних ланцюгів формуються високоспецифічні просторові структури. Встановлено, що послідовність амінокислотних залишків поліпептидного ланцюга білка несе в собі інформацію, необхідну для формування просторової структури білкової молекули. Процес згортання поліпептидного ланцюга в правильну тривимірну структуру отримав назву фолдінг.
До останнього часу вважалося, що формування просторової структури білка відбувається спонтанно, за відсутності будь-яких компонентів. Однак порівняно недавно з'ясувалося, що це справедливо тільки для порівняно невеликих білків (близько 100 амінокислотних залишків). Для фолдинга великих білків необхідні спеціальні білки -шаперони, які створюють можливість швидкого формування правильної просторової структури білка.
Вторинна структура білка представляє собою спосіб згортання поліпептидного ланцюга в спіральну або іншу конформацію. При цьому утворюються водневі зв'язки між СО та NH-групами пептидного остова одного ланцюга або суміжних поліпептидних ланцюгів. Відомо кілька типів вторинної структури пептидних ланцюгів, серед яких головними є # 945; -спіраль і # 946; -складчатий шар.
# 945; -спіралей - жорстка структура, має вигляд стрижня. Внутрішню частину цього стрижня створює туго закручений пептидний кістяк, радикали амінокислот направле-ни назовні. При цьому CO-група кожного амінокислотного залишку взаємодіє з NH-групою четвертого від нього залишку. На один виток спіралі доводиться 3,6 амінокислотних залишку, а крок спіралі складає 0,54 нм. Деякі амінокислоти перешкоджають згортанню ланцюга в # 945; -спіраль, і в місці їх розташування безперервність спіралі порушується. До цих амінокислот відносяться пролин (в ньому атом азоту входить до складу жорсткої кільцевої структури і обертання навколо зв'язку N - Са стає-можливим). а також амінокислоти з зарядженими або об'ємними радикалами, які електростатично або механічно перешкоджають формуванню # 945; -Спіралі.
# 914; -Складчатий шар відрізняється від # 945; -Спіралі тим, що має плоску, а не стержневідной форму. Утворюється за допомогою водневих зв'язків в межах однієї або декількох поліпептидних ланцюгів. Пептидні ланцюги можуть бути розташовані в одному напрямку (паралельно) або в протилежних напрямках (антипараллельно). нагадуючи хутра акордеона. Бічні радикали знаходяться вище і нижче площини шару.
Третинна структура білка - це розподіл в просторі всіх атомів білкової молекули, або інакше кажучи, просторова упаковка спіраль поліпептидного ланцюга. Основну роль в утворенні третинної структури білка грають водневі, іонні, гідрофобні і дисульфідні зв'язки, які утворюються в результаті взаємодії між радикалами амінокислот.
Водневі зв'язки утворюються між двома полярними радикалами, один з яких може мати заряд.
Іонні зв'язку можуть виникати між протилежно зарядженими радикалами.
Гідрофобні взаємодії характерні для неполярних радикалів.
Дисульфідні зв'язки утворюються між SH-групами двох радикалів цистеїну, що знаходяться в різних ділянках поліпептидного ланцюга.
За формою молекули і особливостям формування третинної структури білки ділять на фібрилярні і глобулярні.
Фібрилярні білки - мають ниткоподібну форму (фібрили), утворюють волокна і пучки волокон. Між сусідніми поліпептидними ланцюгами є багато поперечних ковалентних зшивок. Нерозчинні у воді. Переходу в розчин перешкоджають неполярні радикали амінокислот і зшивання між пептидними ланцюгами. В організмі виконують головним чином структурну функцію, забезпечують механічну міцність тканин.
Приклади фібрилярних білків:
КОЛАГЕН- білок сполучної тканини. У його складі переважають амінокислоти гліцин, пролін, гидроксипролин.
Еластін- більш еластичний, ніж колаген, входить до складу стінок артерій, легеневої тканини, в його складі переважають амінокислоти гліцин, аланін, валін.
Кератін- білок епідермісу і похідних шкіри, в його структурі переважає амінокислота цистеїн.
Глобулярні білки - мають сферичну або елліпсовіднимі форму молекули (кулька). У процесі освіти глобули гідрофобні радикали амінокислот занурюються у внутрішні області, гідрофільні радикали розташовуються на поверхні молекули. При взаємодії з водною фазою полярні радикали утворюють численні водневі зв'язку. Білки утримуються в розчиненому стану за рахунок заряду і гідратної оболонки. В організмі глобулярні білки виконують динамічні функції (транспортну, ферментативну, регуляторну, захисну).
Приклади глобулярних білків:
Альбумін- білок плазми крові; містить багато залишків глутамата і аспартату; осідає при 100% -ному насиченні розчину сульфатом амонію.
Глобуліни- білки плазми крові; в порівнянні з альбуміном володіють більшою молекулярною масою і містять менше залишків глутамата і аспартату, осідають при 50% -му насиченні розчину сульфатом амонію.
Гістони- входять до складу ядер клітин, де утворюють комплекс з ДНК. Містять багато залишків аргініну і лізину.
Молекулярні глобули ряду білків, таких як імуноглобуліни, складаються з декількох незалежних, компактно згорнутих фрагментів поліпептидного ланцюга, які називають доменами. Доменні білки є ніби перехідною формою до наступного рівня структурної організації білка.
Четвертичная структура білка - розміщення в просторі взаємодіючих між собою субодиниць, утворених окремими поліпептидними ланцюгами білка. Четвертичная структура - вищий рівень організації білкової молекули, до того ж необов'язковий - більше половини відомих білків її не мають. Білки, що володіють четвертинної структурою, називають також олігомерними, а поліпептидні ланцюги, що входять до їх складу, - субодиницями або протомеров. Протомери можуть бути ідентичними або відзначитися по своїй первинній структурі.
Кожен з протомеров синтезується у вигляді окремої поліпептидного ланцюга, яка згортається в глобулу і потім з'єднується з іншими протомеров. Об'єднання йде шляхом самосборки. Кожен з протомеров містить ділянки, комплементарні іншим протомеров. Взаємодія між контактними ділянками протомеров відбувається за допомогою гідрофобних, іонних і водневих зв'язків.
Прикладами олігомерних білків можуть служити еритроцитарний білок гемоглобін, фермент лактатдегидрогеназа і багато інших. Ці білки можуть існувати у вигляді кількох стійких конформаций. Білки, що володіють четвертинної структурою, характеризуються аллостеріческого властивостями, тобто здатні переходити з однієї конформацій в іншу зі зміною своєї функціональної активності.
Більш детально структурна організація та функціонування олігомерних білків будуть розглянуті в подальшому на прикладі гемоглобіну.
Відомі деякі білки, молекула яких складається з двох або більше поліпептидних ланцюгів, з'єднаних дисульфідними зв'язками (наприклад, гормон інсулін). Такі білки не можна відносити до олігомерного. Дані білки утворюються з єдиної поліпептидного ланцюга в результаті часткового гідролізу - локального розщеплення пептидних зв'язків. Аллостеріческого властивостями, характерними для олігомерних білків, такі білки не володіють.