Доповідь учениці 10 кл. "Б"
Масолової Олени по темі:
Електроліз - це окислювально-відновний процес, що протікає на електродах при проходженні постійного електричного струму через розчин або розплав електролітів.
Для здійснення електролізу до негативного полюса зовнішнього джерела постійного струму приєднують катод. а до позитивного полюса - анод. після чого занурюють їх у електролізер з розчином або розплавом електроліту.
Електроди, як правило, бувають металеві, але застосовуються і неметалеві, наприклад графітові (проводять струм).
На поверхні електрода, підключеного до негативного полюса джерела постійного струму (катоді), іони, молекули або атоми приєднують електрони, т. Е. Протікає реакція електрохімічного відновлення. На позитивному електроді (аноді) відбувається віддача електронів, т. Е. Реакція окислення. Таким чином, сутність електролізу полягає в тому, що на катоді відбувається процес відновлення, а на аноді - процес окислення.
В результаті електролізу на електродах (катоді і аноді) виділяються відповідні продукти відновлення і окислення, які в залежності від умов можуть вступати в реакції з розчинником, матеріалом електрода і т. П. - так звані вторинні процеси.
Металеві аноди можуть бути: а) нерозчинними або інертними (Pt, Au, Ir, графіт або вугілля і ін.), При електролізі вони слугують лише передавачами електронів; б) розчинними (активними); при електролізі вони окислюються.
У розчинах і розплавах різних електролітів є різнойменні по знаку іони, т. Е. Катиони і аніони. які знаходяться в хаотичному русі. Але якщо в такій розплав електроліту, наприклад розплав хлориду натрію NaCl, опустити електроди і пропускати постійний електричний струм, то катіони Na + рухатимуться до катода, а аніони Cl - - до анода. На катоді електролізера відбувається процес відновлення катіонів Na + електронами зовнішнього джерела струму:
На аноді йде процес окислення аніонів хлору, причому відрив надлишкових електронів від Cl - здійснюється за рахунок енергії зовнішнього джерела струму:
Виділяються електронейтральні атоми хлору з'єднуються між собою, утворюючи молекулярний хлор: Cl + Cl = Cl2. який і виділяється на аноді.
Сумарне рівняння електролізу розплаву хлориду натрію:
2NaCl -> 2Na + + 2Cl - - електроліз -> 2Na 0 + Cl2 0
Окислювально-відновну дію електричного струму може бути в багато разів сильніше дії хімічних окислювачів і відновників. Змінюючи напругу на електродах, можна створити майже будь-якої сили окислювачі і відновники, якими є електроди електролітичної ванни або електролізера.
Відомо, що жоден найсильніший хімічний окислювач не може відібрати в фторид-іона F - його електрон. Але це можливо при електролізі, наприклад, розплаву солі NaF. У цьому випадку на катоді (відновник) виділяється з іонного стану металевий натрій або кальцій:
на аноді (окислювач) виділяється іон фтору F -. переходячи з негативного іона у вільний стан:
F - - e - = F 0; F 0 + F 0 = F2 0
-Продукти, що виділяються на електродах, можуть вступати між собою в хімічну взаємодію, тому анодна і катодного простір поділяють діафрагмою.
Практичне застосування електролізу.
Електрохімічні процеси широко застосовуються в різних областях сучасної техніки, в аналітичній хімії, біохімії і т. Д. У хімічній промисловості електролізом одержують хлор і фтор, луги, хлорати і перхлорати, надсірчані кислоту і персульфати, хімічно чисті водень і кисень і т. Д. при цьому одні речовини отримують шляхом відновлення на катоді (альдегіди, параамінофенол і ін.), інші електроокислення на аноді (хлорати, перхлорати, перманганат калію та ін.).
Електроліз в гідрометалургії є однією з стадій переробки металлсодержащего сировини, що забезпечує отримання товарних металів.
Електроліз може здійснюватися з розчинними анодами - процес електрорафінування або з нерозчинними - процес електроекстракціі.
Головним завданням при електрорафінування металів є забезпечення необхідної чистоти катодного металу при прийнятних енергетичних витратах.
У кольоровій металургії електроліз використовується для вилучення металів з руд і їх очищення. Електролізом розплавлених середовищ отримують алюміній, магній, титан, цирконій, уран, берилій та ін.
Для рафінування (очищення) металу електролізом з нього відливають пластини і поміщають їх в якості анодів в електролізер. При пропущенні струму метал, що підлягає очищенню, піддається анодному розчиненню, т. Е. Переходить в розчин у вигляді катіонів. Потім ці катіони металу розряджаються на катоді, завдяки чому утворюється компактний осад вже чистого металу. Домішки, що знаходяться в аноді, або залишаються нерозчинними, або переходять в електроліт і видаляються.
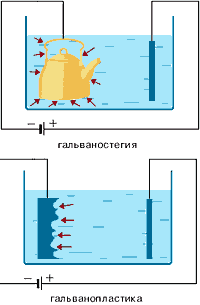
Гальванотехніка - область прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих, так і неметалевих виробів при проходженні постійного електричного струму через розчини їх солей. Гальванотехніка пожразделяется на гальваностегію і гальванопластику.
¨ Гальваностегія (від грец. Покривати) - це електроосадження на поверхню металу іншого металу, який міцно зв'язується (зчіплюється) з покриваються металом (предметом), службовцям катодом електролізера.
Перед покриттям вироби необхідно його поверхню ретельно очистити (знежирити і протравити), в іншому випадку метал буде осідати нерівномірно, а крім того, зчеплення (зв'язок) металу покриття з поверхнею виробу буде нестійкою. Способом гальваностегії можна покрити деталь тонким шаром золота або срібла, хрому або нікелю. За допомогою електролізу можна наносити найтонші металеві покриття на різних металевих поверхнях. При такому способі нанесення покриттів, деталь використовують як катода, вміщеного в розчин солі того металу, покриття з якого необхідно отримати. Як анода використовується платівка з того ж металу.
¨ Гальванопластика - отримання шляхом електролізу точних, легко відокремлюваних металевих копій щодо значної товщини з різних як неметалічних, так і металевих предметів, які називаються матрицями.
За допомогою гальванопластики виготовляють погруддя, статуї і т. Д.
Гальванопластика використовується для нанесення порівняно товстих металевих покриттів на інші метали (наприклад, освіту "накладного" шару нікелю, срібла, золота і т. Д.).
Крім зазначених вище, електроліз знайшов застосування і в інших областях:
-отримання оксидних захисних плівок на металах (анодування);
-електрохімічна обробка поверхні металевого виробу (поліровка);
-електрохімічне фарбування металів (наприклад, міді, латуні, цинку, хрому та ін.);
-очищення води - видалення з неї розчинних домішок. В результаті виходить так звана м'яка вода (за своїми властивостями наближається до дистильованої);
-електрохімічна заточка ріжучих інструментів (наприклад, хірургічних ножів, бритв і т.д.).
Спасибі, виручили! Зроби паузу, студент, ось розважся: Препод на іспиті: От раніше, в молодості, я лютував - закидав студентів тільки так, а зараз постарів, подобрішав. візьміть заліковку, прийдете на перездачу. До речі, анекдот узятий з chatanekdotov.ru