Комплексними сполуками називаються сполуки, що існують як в кристалічному стані, так і в розчині, особливістю яких є наявність центрального атома, оточеного лигандами. Комплексні сполуки можна розглядати як складні сполуки вищого порядку, що складаються з простих молекул, здатних до самостійного існування в розчині.
Координаційну теорію Вернера розглянемо на прикладі:
зовнішня і внутрішня сфера
Відповідно до цієї теорії, центральний атом або іон. в більшості випадків у формі катіона (зазвичай позитивно заряджений), координує (тобто близько розпорядженні) навколо себе певну кількість аніонів або молекул, які називаються лігандами. (Або аддендов - стара назва). Прості позитивно заряджені катіони в ролі лігандів не виступають.
Центральний атом (комплексоутворювач)
Освіта комплексного іона або нейтрального комплексу можна уявити собі у вигляді оборотної реакції загального типу:
де M - нейтральний атом, позитивно або негативно заряджений умовний іон, який об'єднує (координуючий) навколо себе інші атоми, іони або молекули L. Атом M отримав назву комплексоутворювача або центрального атома.
У комплексних іонах [Cu (NH3) 4] 2+. [SiF6] 2. [Fe (CN) 6] 4. [BF4] - комплексоутворювачами є мідь (II), кремній (IV), залізо (II), бор (III). Найчастіше комплексоутворювачем служить атом елемента в позитивній ступеня окислення.
Негативні умовні іони (тобто атоми в негативній ступеня окислення) грають роль комплексообразователей порівняно рідко. Це, наприклад, атом азоту (III) в катіоні амонію [NH4] + і т.п.
Атом-комплексоутворювач може володіти нульовим ступенем окислення. Так, карбонільні комплекси нікелю і заліза, які мають склад [Ni (CO) 4] і [Fe (CO) 5], містять атоми нікелю (0) і заліза (0).
Комплексоутворювач (виділено жирно) може брати участь в реакціях одержання комплексів, як будучи одноатомних іоном, наприклад:
так і перебуваючи в складі молекули:
У комплексній частці може бути два і більше атомів-комплексоутворювачів. У цьому випадку говорять про багатоядерних комплексах.
Комплексне з'єднання може включати кілька комплексних іонів, в кожному з яких міститься свій комплексообразователь.
Наприклад, в одноядерному комплексному поєднанні складу [K (H2 O) 6] [Al (H2 O) 6] (SO4) 2 комплексообразователи K (I) і Al (III), а в [Cu (NH3) 4] [PtCl6] - Cu (II) і Pt (IV).
У комплексному іоні або нейтральному комплексі навколо комплексоутворювача координуються іони, атоми або прості молекули (L). Всі ці частинки, що мають хімічні зв'язки з комплексоутворювачем, називаються лігандами (від латинського «ligare» - пов'язувати). У комплексних іонах [SnCl6] 2- і [Fe (CN) 6] 4 лигандами є іони Cl - і CN -. а в нейтральному комплексі [Cr (NH3) 3 (NCS) 3] ліганди - молекули NH3 і іони NCS -.
Ліганди, як правило, не пов'язані один з одним, і між ними діють сили відштовхування. В окремих випадках спостерігається міжмолекулярної взаємодії лігандів з утворенням водневих зв'язків.
Лігандами можуть бути різні неорганічні і органічні іони і молекули. Найважливішими лигандами є іони CN -. F -. Cl -. Br -. I -. OH -. SO3 S2 -. C2 O4 2. CO3 2-. молекули H2 O, NH3. CO, карбаміду (NH2) 2 CO, органічних сполук - етілендіаміна NH2 CH2 CH2 NH2. # 945; -аміноуксусной кислоти NH2 CH2 COOH і етилендиамінтетраоцетової кислоти (ЕДТА):
Найчастіше ліганд буває пов'язаний з комплексоутворювачем через один зі своїх атомів однієї двухцентровой хімічним зв'язком. Такого роду ліганди отримали назву монодентатно. До числа монодентатно лігандів можна адресувати галогенид-іони, ціанід-іон, аміак, вода і інші.
Деякі поширені ліганди типу молекул води H2 O, гідроксид-іона OH -. тиоцианат-іона NCS -. амід-іона NH2 -. монооксиду вуглецю CO в комплексах переважно монодентатно, хоча в окремих випадках (в мостікових структурах) стають бідентатно.
Існує цілий ряд лігандів, які в комплексах є практично завжди бідентатно. Це етилендіамін, карбонат-іон, оксалат-іон і т.п. Кожна молекула або іон бідентатного лиганда утворює з комплексоутворювачем дві хімічні зв'язки відповідно до особливостей своєї будови:
Наприклад, в комплексному поєднанні [Co (NH3) 4 CO3] NO3 бідентатно ліганд - іон CO3 2- утворює дві зв'язку з комплексоутворювачем - умовним іоном Co (III), а кожна молекула ліганда NH3 - тільки одну зв'язок:
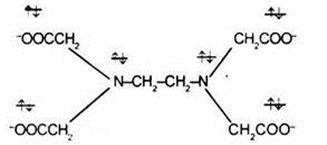
Прикладом гексадентатного лиганда може служити аніон етилендіамінтетраоцтової кислоти:
Полідентатними ліганди можуть виступати в ролі мостікових лігандів, які об'єднують два і більше центральних атома.
Число лігандів, що оточують центральний іон, називається координаційним числом (КЧ). Координаційне число може мати значення 2; 3; 4; 5; 6 і т.д. аж до 12 (наприклад, для деяких з'єднань рідкоземельних металів). Найбільш часто зустрічаються координаційні числа 2; 4; 6. Координаційні числа вище 8 зустрічаються рідше.
Значення кч комплексообразователя залежать від багатьох чинників:
- від природи ліганда і його електронних властивостей;
але зазвичай воно дорівнює подвоєному заряду іона комплексоутворювача.
Між значеннями координаційного числа і ступенем окислення елемента-комплексообразователя існує певна залежність. Так, для елементів-комплексоутворювачів, що мають ступінь окислення +1 (Ag 1. Cu 1. Au 1. I 1 і ін.) Найбільш характерно координаційне число 2 - наприклад, в комплексах типу [Ag (NH3) 2] +. [Cu (CN) 2] -. [IBr2] -.
Елементи-комплексообразователи зі ступенем окислення +2 (Zn 2. Pt 2. Pd 2. Cu 2 та ін.) Часто утворюють комплекси, в яких виявляють координаційне число 4, такі як [Zn (NH3) 4] 2+. [PtCl4] 2 -. [Pd (NH3) 2Cl2] 0. [ZnI4] 2 -. [Cu (NH3) 4] 2+.
У Аквакомплекс координаційне число комплексоутворювача в ступені окислення + II найчастіше дорівнює 6: [Fe (H2 O) 6] 2+. [Mg (H2 O) 6] 2+. [Ni (H2 O) 6] 2+.
Елементи-комплексообразователи, що володіють ступенем окислення +3 і +4 (Pt 4. Al 3. Co 3. Cr 3. Fe 3), мають в комплексах, як правило, КЧ = 6.
Наприклад, [Co (NH3) 6] 3+. [Cr (OH) 6] 3. [PtCl6] 2. [AlF6] 3. [Fe (CN) 6] 3.
Відомі комплексообразователи, які мають практично постійним координаційним числом в комплексах різних типів. Такі кобальт (III), хром (III) або платина (IV) з КЧ = 6 і бор (III), платина (II), паладій (II), золото (III) з КЧ = 4. Тим не менше, більшість комплексообразователей має змінне координаційне число. Наприклад, для алюмінію (III) можливі КЧ = 4 і КЧ = 6 в комплексах [Al (OH) 4] - і [Al (H2 O) 2 (OH) 4] -.
Координаційні числа 3, 5, 7, 8 і 9 зустрічаються порівняно рідко. Є лише кілька з'єднань, в яких КЧ дорівнює 12 - наприклад, таких як K9 [Bi (NCS) 12].
Центральний атом разом з координованими лигандами утворюють внутрішню координаційну (тобто комплексну) сферу. яку під час запису формули укладають у квадратні дужки. Інші іони, які не розмістилися у внутрішній сфері, перебувають на більш далекій відстані від центрального іона, складаючи зовнішню координаційну сферу. Зображуючи формулу комплексної сполуки, зовнішньосферних іони мають за квадратними дужками.
Наприклад, в з'єднаннях [Cu (NH3) 4] (OH) 2 і K2 [HgI4] зовнішньосферних іонами є відповідно іони OH - і K +. У нейтральних комплексах [Cr (NH3) 3 (NCS) 3] 0 і [Pd (NH3) 2 Cl2] 0 зовнішня сфера відсутня.
Зазвичай зовнішню сферу складають прості одноатомні або багатоатомні іони. Однак можливі випадки, коли комплексна сполука складається з двох і більше внутрішніх сфер, що виконують функції катионной і аніонної частини з'єднання. Тут кожна з внутрішніх сфер є зовнішньою по відношенню до іншої.
Наприклад, в з'єднаннях [Cu (NH3) 4] [PtCl6] і [Ni (NH3) 6] 2 [Fe (CN) 6] формально функції зовнішньосферних іонів можуть виконувати:
- комплексні аніони [PtCl6] 2- і [Fe (CN) 6] 4.
Комплексні сполуки, що мають зовнішню сферу, є сильними електролітами і в водних розчинах дисоціюють практично без остачі на комплексний іон і іони зовнішньої сфери. При обмінних реакціях комплексні іони переходять з одних сполук в інші, не змінюючи свого складу.
У внутрішній сфері зв'язок комплексообразователя з лігандами має донорно-акцепторна походження і є ковалентним. Роль акцептора електронів виконує комплексообразователь, що має вільні орбіталі і досить великий позитивний заряд ядра, а роль донора виступають ліганди, здатні віддавати комплексообразователи неподеленную електронну пару. Іони, що знаходяться у зовнішній сфері, пов'язані з комплексним іонів в основному силами електростатіческогого взаємодії.
Визначення заряду (z) основних частинок комплексного з'єднання на прикладі: K [Al (OH) 4].
Заряд внутрішньої сфери комплексної сполуки дорівнює алгебраїчній сумі зарядів комплексоутворювача і всіх лігандів:
Навпаки, знаючи заряд комплексного іона і заряди лігандів [Al (OH) 4] -), можна визначити ступеня окислення комплексоутворювача: х + (-1) × 4 = -1; х = +3. Ступінь окислення алюмінію +3.
Заряд внутрішньої сфери компенсується іонами зовнішньої сфери комплексної сполуки. У наведеному прикладі внутрішньої координаційної сферою є [Al (OH) 4] -. Заряд аниона в цьому випадку компенсує катіон К +. що знаходяться у зовнішній координаційній сфері.
Як лигандов виступають молекули або іони, що містять донорні атоми (найбільш поширені N, Р, О, галогени), здатні віддавати комплексообразователи неподеленную електронну пару.
Число місць, займаних кожним лигандом у внутрішній сфері комплексного з'єднання, називається координаційної ємністю (дентатність) ліганда. Вона визначається числом електронних пар лиганда, які беруть участь в утворенні координаційного зв'язку з центральним атомом.
За кількістю зв'язків, утворених лігандами з комплексоутворювачем. ліганди діляться на моно-, ди-і полідентатними ::
1. До монодентатно відносяться аніони F -. Сl -. Вг -. I -. H -. CN -. NO -. SCN - і т.д. нейтральні молекули (NH3. аміни, наприклад, первинні RNH2 (R - органічний радикал), молекули води і т.д.), що мають тільки один донорний атом.
2. До бідентатно лигандам відносяться молекули або іони, що містять дві функціональні групи, здатні бути донором двох електронних пар. наприклад,
Молекула етілендіаміна Діаніон щавлевої кислоти
3. До полідентатними лигандам можна віднести 6-дентатність ліганд тетрааніон етілендіамінтріуксусной кислоти (ЕДТА):