Фактори, що впливають на ККМ
ККМ залежить від багатьох факторів, але перш за все визначається будовою вуглеводневого радикала, природою полярної групи, добавками в розчин різних речовин і температурою.
Довжина вуглеводневої радикала R.
Для водних розчинів - в гомологічної ряду для сусідніх гомологів ставлення ККМ ≈ 3,2 має значення коефіцієнта правила Дюкло-Траубе. Чим більше R, тим сильніше знижується енергія системи при міцеллообразованія, тому, чим довше вуглеводневий радикал, тим менше ККМ.
Здатність до асоціації проявляється у молекул ПАР при R> 8-10 атомів вуглецю С. Розгалуженість, ненасиченість, циклизация зменшують схильність до МЦО і ↑ ККМ.
Наявність йоногенних груп збільшує розчинність ПАР у воді, тому для переходу йоногенних молекул в міцелу виграється менше енергії, ніж для неіоногенних молекул. Тому ККМ для йоногенних ПАР зазвичай вище, ніж для неіоногенних, при однаковій гидрофобности молекули (числі атомів вуглецю в ланцюгах).
Вплив добавок електролітів і полярних органічних речовин.
Введення електролітів в розчини ІПАВ і НІПАВ викликає неоднаковий ефект:
1) в розчинах ІПАВ ↑ Сел-ту ↓ ККМ.
Основну роль відіграють концентрація і заряд противоионов. Іони, заряджені однойменно з ПАР-іоном в МЦ, слабо впливають на ККМ.
Полегшення МЦО пояснюється стисненням дифузного шару протиіонів, придушенням дисоціації молекул ПАР і часткової дегідратацією іонів ПАР.
Зниження заряду міцел послаблює електростатичне відштовхування і полегшує приєднання нових молекул до міцелі.
На МЦО НІПАВ добавка електроліту позначається мало.
2) Додавання органічних речовин у водні розчини ПАР по-різному впливає на ККМ:
низькомолекулярні сполуки (спирти, ацетон) ↑ ККМ (якщо немає солюбилизации)
довголанцюгові з'єднання ↓ ККМ (стійкість міцел зростає).
3). Вплив температури Т.
Спостерігається різний характер впливу Т на ІПАВ і НІПАВ.
Збільшення Т на розчини ІПАВ підсилює тепловий рух і перешкоджає агрегації молекул, але інтенсивний рух зменшує гідратацію полярних груп і сприяє їх об'єднанню.
Багато ПАР з великим R через погану розчинність не утворюють міцелярних розчинів. Однак при зміні Т розчинність ПАР може зрости і виявляється МЦО.
Т, при кіт. збільшується розчинність ІПАВ через утворення МЦ, називається точкою Крафта (зазвичай 283-293 К).
Т. Крафта не збігається з ТПЛ тв. ПАР, а лежить нижче, тому що в набряклому гелі ПАР гідратованих і це полегшує плавлення.
Мал. 7.2. Фазова діаграма розчину колоїдного ПАР поблизу точки Крафта
Для отримання ПАР з низьким значення точки Крафта:
а) вводять додатковий СН3 - або бічні заступники;
б) вводять непредельную зв'язок «=»;
в) полярний сегмент (оксіетиленових) між іонної групою і ланцюгом.
Вище точки До рафта МЦ ІПАВ розпадаються на більш дрібні асоціати - відбувається деміцеллізація.
(Міцеллообразованія відбувається в певному для кожного ПАР інтервалі температур, найважливішими характеристиками якого є точка Крафта і точка помутніння.
Точка Крафта - нижній температурний межа міцеллообразованія йоногенних ПАР, зазвичай вона дорівнює 283 - 293К; при температурах нижче точки Крафта розчинність ПАР недостатня для утворення міцел.
Точка помутніння - верхня температурна межа міцеллообразованія неіоногенних ПАР, звичайні її значення 323 - 333 К; при більш високих температурах система ПАР - розчинник втрачає стійкість і розшаровується на дві макрофази.)
2) ↑ Т в розчинах НІПАВ ↓ ККМ за рахунок дегідратації оксіетиленових ланцюжків.
У розчинах НІПАВ спостерігається температура помутніння - верхня температурна межа МЦО НІПАВ (323-333 К), при більш високих Т система втрачає стійкість і розшаровується на дві фази.
Термодинаміка і механізм міцеллообразованія (МЦО)
(Справжня розчинність ПАР обумовлена збільшенням ентропії S при розчиненні і в меншій мірі взаємодією з молекулами води.
Для ІПАВ характерна дисоціація в воді, S розчинення їх значна.
НІПАВ слабо взаємодіють з Н2 О, їх розчинність менше при тому ж R. Найчастіше? Н> 0, тому розчинність ↑ при ↑ Т.
Мала розчинність ПАР проявляється в «+» поверхневої активності, а з ↑ С - в значній асоціації молекул ПАР, що переходить в МЦО. )
Розглянемо механізм розчинення ПАР. Він складається з 2 стадій: фазового переходу і взаємодії з молекулами розчинника - сольватацией (водою і гідратацією):
ΔНф.п.> 0 ΔSф.п.> 0 ΔНраств.> 0 і ΔG розчин. -3 моль / л), починаючи з ККМ, формуються іонні міцели, оточені дифузним шаром противоионов, хід залежності = f () порушується і на лінії спостерігається злам.
Інший метод визначення ККМ заснований на вимірюванні поверхневого натягу водних розчинів ПАР, яке зменшується з ростом концентрації аж до ККМ, а потім залишається майже незмінним. Цей метод можна застосовувати як для йоногенних, так і для неіоногенних ПАР. Для визначення ККМ досвідчені дані по залежності від C зазвичай представляють у координатах = f (lnC) (рис. 7.3).
Ізотерми σ = f (C) відрізняються від ізотерм істинних розчинів ПАР різкішим ↓ σ з ↑ С і наявністю зламу в області малих концентрацій (близько 10 -3 - 10 -6 моль / л), вище яких σ залишається постійною. Більш різко ця точка ККМ виявляється на изотерме σ = f ln (C) відповідно до
Графік залежності показника заломлення n від концентрації розчину ПАР є ламаною лінією з двох відрізків, що перетинаються в точці ККМ (рис. 7.4). З цієї залежності можна визначити ККМ ПАР у водних і неводних середовищах.
В області ККМ істинний (молекулярний) розчин переходить в колоїдний розчин, при цьому різко зростає світлорозсіювання системи (кожен міг спостерігати розсіювання світла на порошинки, зважених в повітрі). Для визначення ККМ методом світлорозсіювання вимірюють оптичну щільність системи D в залежності від концентрації ПАР (ріс.7.5), ККП знаходять з графіка D = f (C).
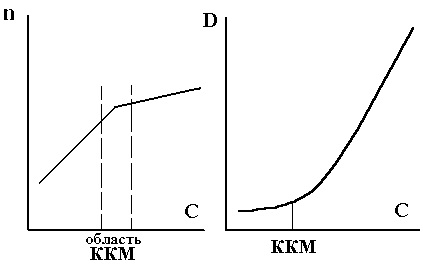
Мал. 7.4. Визначення ККМ методом вимірювання показника заломлення n.
Мал. 7.5. Визначення ККМ методом світлорозсіювання (праворуч).