1. Поняття про хімічні реакції
2. Класифікація хімічних реакцій за різними ознаками
Список використаної літератури
Речовини, взаємодіючи один з одним, піддаються різним змінам і перетворенням. Наприклад, берилій взаємодіючи з киснем повітря при температурі понад 500 ° С, перетворюється в оксид берилію; вугілля, згораючи, утворює вуглекислий газ, і т.п.
Явища, при яких одні речовини перетворюються в інші, що відрізняються від вихідних складом і властивостями, і при цьому не відбувається зміни складу ядер атомів, називаються хімічними.
Окислення на повітрі, горіння, отримання металів з руд, іржавіння заліза - все це хімічні явища. Інакше їх називають хімічними перетвореннями, хімічними реакціями або хімічними взаємодіями.
Метою даної роботи є вивчення особливостей хімічних реакцій і їх класифікацію.
Робота складається з вступу, двох розділів, висновків та списку використаних джерел. Загальний обсяг роботи 17 сторінок.
1. Поняття про хімічні реакції
Хімічні властивості речовин виявляються в різноманітних хімічних реакціях. Перетворення речовин, що супроводжуються зміною їх складу та (або) будови і називаються хімічними реакціями.
Часто трапляється й таке визначення: хімічною реакцією називається процес перетворення вихідних речовин (реагентів) в кінцеві речовини (продукти).
Реагенти- речовини, що вступають в хімічну реакцію.
Продукти- речовини, які утворюються в результаті хімічної реакції.
Реагенти → Продукти
У перекладі з латині «реакція» означає «протидія, відсіч, відповідна дія». Отже термін хімічна реакція можна розуміти як відповідна дія речовини на вплив ззовні інших речовин і фізичних факторів - тепла, тиску, випромінювання. Але під таке визначення підпадають і фізичні процеси: плавлення, кипіння, замерзання та інші. Тому слід уточнити, що хімічна реакція - це така зміна речовин, при якому розриваються старі і утворюються нові хімічні зв'язки між частинками (атомами, іонами), у тому числі побудовано речовини.
«Рушійна сила» реакції залежить не тільки від природи реагентів і утворюються речовин (їх складу, будови), а й від концентрації речовин, температури, тиску, впливу розчинників, з'єднань, здатних утворювати комплекси з реагентами і продуктами.
Хімічні реакції завжди супроводжуються фізичними ефектами - поглинанням або виділенням теплоти, змінами агрегатного стану і забарвлення речовин; за наявністю цих ефектів часто судять про протікання реакцій (рис.1).
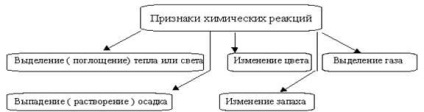
Малюнок 1 - Ознаки хімічних реакцій
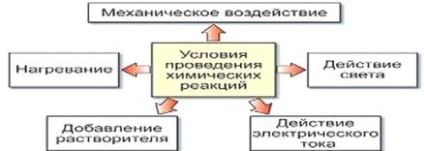
Хімічні реакції слід відрізняти від фізичних процесів, що змінюють тільки зовнішню форму або агрегатний стан речовини (але не його складу). Умови, які повинні виконуватися, щоб відбулася хімічна реакція:
1. Необхідно, щоб реагуючі речовини стикнулися і чим більше площа їхнього зіткнення, тим швидше відбудеться хімічна реакція.
2. Деякі реакції йдуть без нагрівання, для деяких реакцій воно необхідне.
3. Деякі реакції протікають під дією електричного струму і світла
Хімічні реакції записуються за допомогою хімічних рівнянь. містять формули вихідних речовин і продуктів реакції, наприклад:
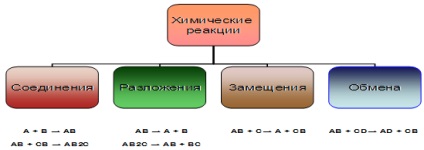
A + B = AB З декількох простих або складних речовин утворюється одне складне
AB = A + B З складного речовини утворюється кілька простих або складних речовин
A + BC = AC + B Атом простого речовини заміщає один з атомів складного
AB + CD = AD + CB Складні речовини обмінюються своїми складовими частинами
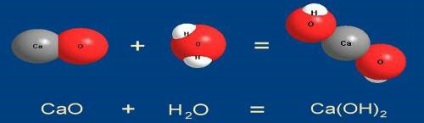
1. Реакції з'єднання. Д. І. Менделєєв визначав з'єднання як реакцію, «при якій з двох речовин відбувається одне. Отже, при реакціях з'єднання з декількох реагуючих речовин відносно простого складу виходить одна речовина більш складного складу
До реакцій сполуки відносять процеси горіння простих речовин (сірки, фосфору, вуглецю) на повітрі. Наприклад, вуглець горить на повітрі З + О2 = СО2 (звичайно ця реакція протікає поступово, спочатку утворюється чадний газ СО). Як правило, ці реакції супроводжуються виділенням тепла, тобто призводять до утворення більш стійких і менш багатих енергією з'єднань - є екзотермічні.
Реакції з'єднання простих речовин завжди носять окислювально-відновний характер. Реакції з'єднання, що протікають між складними речовинами, можуть відбуватися як без зміни валентності
СаСО3 + СО2 + Н2О = Са (НСО3) 2
так і ставитися до числа окислювально-відновних
2FеСl2 + Сl2 = 2FеСl3.
2. Реакції розкладання. Хімічні реакції розкладання, по Менделєєву, «становлять випадки, зворотні з'єднанню, тобто такі, при яких одна речовина дає два, або, взагалі, дане число речовин - більше їх число.
Реакції розкладу призводять до утворення декількох з'єднань з одного складного речовини
Продуктами розкладання складної речовини можуть бути як прості, так і складні речовини. Прикладом реакції розкладання може служити хімічна реакція розкладання крейди (або вапняку під впливом температури): СаСО3 = СаО + СО2. Для проведення реакції розкладання, як правило, потрібно нагрівання. Такі процеси - ендотермічні, тобто протікають з поглинанням теплоти. З реакцій розкладання, що протікають без зміни валентних станів, слід зазначити розкладання кристалогідратів, підстав, кислот і солей кисневмісних кислот
CuSO4 5H2O = CuSO4 + 5H2O,
Cu (OH) 2 = CuO + H2O,
H2SiO3 = SiO2 + H2O.
До реакцій розкладання окислювально-відновного характеру відноситься розкладання оксидів, кислот і солей, утворених елементами в вищих ступенях окислення
4HNO3 = 2H2O + 4NO2O + O2O,
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4) 2Cr2O7 = Cr2O3 + N2 + 4H2O.
Особливо характерні окисно-відновні реакції розкладання для солей азотної кислоти.
Реакції розкладу в органічній хімії, на відміну від реакцій розкладання в неорганічної хімії, мають свою специфіку. Їх можна розглядати як процеси, зворотні приєднання, оскільки в результаті найчастіше утворюються кратні зв'язку або цикли.
Реакції розкладу в органічній хімії звуться крекінгу
С18H38 = С9H18 + С9H20
або дегідрірованія C4H10 = C4H6 + 2H2.
У реакціях двох інших типів число реагентів дорівнює числу продуктів.
3. Реакції заміщення. Їх відмітна ознака - взаємодія простого речовини зі складним. Такі реакції є і в органічній хімії. Однак поняття «заміщення» в органіці ширше, ніж в неорганічної хімії. Якщо в молекулі вихідної речовини будь-якої атом або функціональна група замінюються на інший атом або групу, це теж реакції заміщення, хоча з точки зору неорганічної хімії процес виглядає як реакція обміну.
При реакціях заміщення зазвичай проста речовина взаємодіє зі складним, утворюючи інше проста речовина і інше складне А + ВС = АВ + С
Наприклад, опустивши сталевий цвях в розчин мідного купоросу отримуємо залізний купорос (залізо витіснило мідь з її солі) Fe + CuSO4 = FeSO4 + Cu.
Ці реакції в переважній більшості належать до окисно-відновних
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
Приклади реакцій заміщення, що не супроводжуються зміною валентних станів атомів, вкрай нечисленні.
Слід зазначити реакцію двоокису кремнію з солями кисневмісних кислот, яким відповідають газоподібні або леткі ангідриди
СаСО3 + SiO2 = СаSiO3 + СО2,
Са3 (РО4) 2 + ЗSiO2 = ЗСаSiO3 + Р2О5.
Іноді ці реакції розглядають як реакції обміну
СН4 + Сl2 = СН3Сl + НСl.
4. Реакції обміну (в тому числі і нейтралізації). Реакціями обміну називають реакції між двома з'єднаннями, які обмінюються між собою своїми складовими частинами
Велике їх число протікає у водних розчинах. Прикладом хімічної реакції обміну може служити нейтралізація кислоти лугом
Тут в реагентах (речовинах, що стоять зліва) іон водню із з'єднання HCl обмінюється з іоном натрію із з'єднання NaOH, в результаті чого утворюється розчин кухонної солі у воді.
Якщо при реакціях заміщення протікають окислювально-відновні процеси, то реакції обміну завжди відбуваються без зміни валентного стану атомів. Це найбільш поширена група реакцій між складними речовинами - оксидами, основами, кислотами та солями
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr + КNО3,
СrСl3 + ЗNаОН = Сr (ОН) 3 + ЗNаСl.
Окремий випадок цих реакцій обміну - реакції нейтралізації
НСl + КОН = КСl + Н2О.
Зазвичай ці реакції підкоряються законам хімічної рівноваги і протікають в тому напрямку, де хоча б одне з речовин видаляється зі сфери реакції у вигляді газоподібного, летючого речовини, осаду або малодиссоциирующие (для розчинів) з'єднання
NаНСО3 + НСl = NаСl + Н2О + СО2 ↑,
Са (НСО3) 2 + Са (ОН) 2 = 2СаСО3 ↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
Однак дуже багато реакції не вкладаються в наведену просту схему. Наприклад, хімічна реакція між перманганатом калію (марганцівкою) і йодидом натрію не може бути віднесена ні до одного із зазначених типів. Такі реакції, як правило, називають окисно відновні, наприклад 2KMnO4 + 10NaI + 8H2 SO4 = 2MnSO4 + K2 SO4 + 5Na2 SO4 + 5I2 + 8H2 O.
До окислювально-відновним в неорганічної хімії відносяться всі реакції заміщення і ті реакції розкладу і сполуки, в яких бере участь хоча б одне просте речовина. У більш узагальненому варіанті (вже з урахуванням і органічної хімії), все реакції за участю простих речовин. І, навпаки, до реакцій, що йдуть без зміни ступенів окислення елементів, що утворюють реагенти і продукти реакції, відносяться всі реакції обміну.
2. Класифікація реакцій по фазовим ознаками
Залежно від агрегатного стану реагуючих речовин розрізняють наступні реакції:
1. Газові реакції:
2. Реакції в розчинах:
NaОН (р-р) + НСl (p-p) = NaСl (p-p) + Н2О (ж).
3. Реакції між твердими речовинами:
СаО (тв) + SiO2 (тв) = СаSiO3 (тв).
3. Класифікація реакцій за кількістю фаз
Під фазою розуміють сукупність однорідних частин системи з однаковими фізичними і хімічними властивостями і відокремлених один від одного поверхнею розділу.
Все різноманіття реакцій з цієї точки зору можна розділити на два класи.
1. Гомогенні (однофазні) реакції. До них відносять реакції, що протікають у газовій фазі, і цілий ряд реакцій, що протікають в розчинах.
2. Гетерогенні (багатофазні) реакції. До них відносять реакції, в яких реагенти і продукти реакції перебувають в різних фазах. наприклад:
CO2 (г) + NaOH (p-p) = NaHCO3 (p-p),
СO2 (г) + СаО (тв) = СаСO3 (тв),
Na2SO4 (р-р) + ВаСl3 (р-р) = ВаSО4 (тв) ↓ + 2NaСl (p-p),
Са (НСО3) 2 (р-р) + Н2SО4 (р-р) = СО2 (г) ↑ + Н 2 О (ж) + СаSО4 (тв) ↓.
4. Класифікація реакцій за типом переносите часток
Читати далі: Протолітичні реакції
Інформація про роботу «Поняття хімічних реакцій та їх класифікація»
Розділ: Хімія
Кількість знаків з пробілами: 20245
Кількість таблиць: 2
Кількість зображень: 2
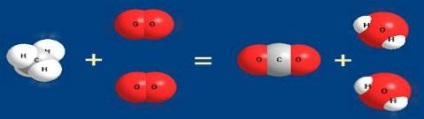
- реакції, що йдуть без зміни ступеня окислення: S + 4O4-2 + H2O → H2 + S + 4O4-2 CH3NH2 + HCl → (CH3NH3) Cl Як бачимо, існує різні способи класифікації хімічних реакцій, з яких більш детально ми розглянемо наступні. За ознакою зміни числа вихідних і кінцевих речовин. Тут можна знайти 4 типи хімічних реакцій (рис.6): реакції з'єднання, реакції розкладання.
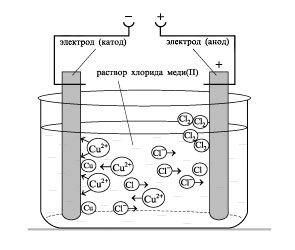
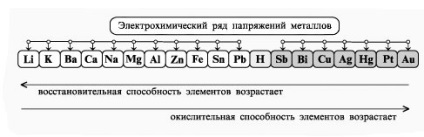
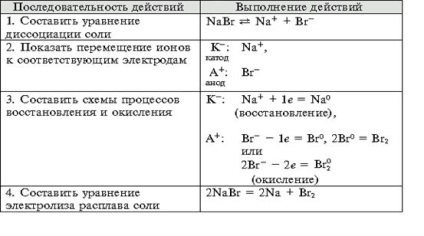
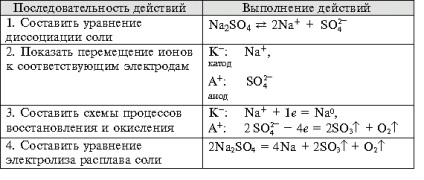
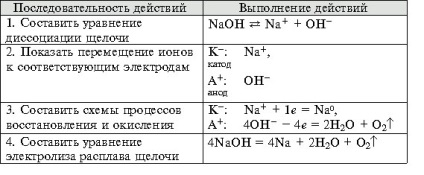
- Формування навичок техніки виконання експерименту, вміння вирішувати розрахункові та якісні задачі, складати рівняння хімічних реакцій, що протікають при електролізі розчинів і розплавів електролітов.- Виховання самостійності, організованості, формування вміння працювати в групі, розвиток творчих здібностей, логічного мислення, уваги, пам'яті. Обладнання: комп'ютер.
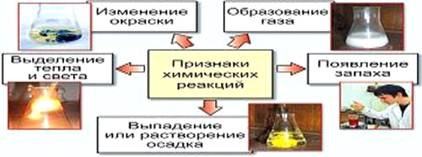
Реакція середовища в цьому випадку залежить від співвідношення констант дисоціації відповідних підстави і кислоти. Посилити гідроліз можна розведенням розчину, нагріванням системи. 2. Хімічні реакції Хімічні реакції (хімічні явища) - це процеси, в результаті яких одні речовини перетворюються в інші. Ознаками здійснення хімічних реакцій є: - зміна кольору ;.