Візьмемо речовину у вигляді рідини і знаходиться з нею в рівновазі насиченої пари і, не змінюючи обсягу, станемо віднімати від нього тепло. Цей процес буде супроводжуватися зниженням температури речовини і відповідним зменшенням тиску. Тому точка, яка зображує стан речовини на діаграмі (р, Т), переміщається вниз по кривій випаровування (рис. 47а). Це продовжується до тих пір, поки не буде досягнута температура кристалізації речовини, що відповідає рівноважного значення тиску. Позначимо цю температуру tтр. Весь час, поки йде процес кристалізації, температура і тиск залишаються незмінними. Відводиться при цьому тепло являє собою тепло, що виділяється при кристалізації.
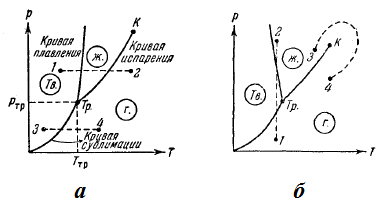
Мал. 47. Діаграми стану
Температура tтр і відповідне їй рівноважний тиск РТР - єдині значення температури і тиску, при яких можуть знаходитися в рівновазі три фази речовини: тверда, рідка і газоподібна. Відповідна точка на діаграмі (р, Т) називається потрійною точкою. Таким чином, потрійна точка визначає умови, при яких можуть знаходитися в рівновазі одночасно три фази речовини.
Після закінчення процесу кристалізації в рівновазі будуть перебувати тверда і газоподібна фази. Якщо продовжувати забирати від речовини тепло, то тим-пература знову почне знижуватися. Відповідно зменшується тиск парів, що знаходяться в рівновазі з кристалічною фазою. Точка, що зображає стан речовини, переміщається вниз по кривій сублімації.
Температура потрійний точки є температура, при якій плавиться речовина, перебуваючи під тиском, рівним РТР. При інших тисках температура плавлення буде інший. Зв'язок між тиском і температурою плавлення відіб'ється, кривої плавлення, що починається в потрійній точці. Таким чином, потрійна точка виявляється лежить на перетині трьох кривих, що визначають умови рівноваги двох фаз: твердої і рідкої, рідкої і газоподібної і, нарешті, твердої і газоподібної.
Залежно від співвідношення між питомими обсягами твердої і рідкої фаз крива плавлення йде або так, як на рис. 47а. або так, як на рис. 47б.
Криві плавлення, випаровування і сублімації розбивають координатну площину на три області. Зліва від кривих сублімації і плавлення лежить область твердої фази, між кривими плавлення і випаровування укладена область рідких станів і, нарешті, справа від кривих випаровування і сублімації простягається область газоподібних станів речовини. Будь-яка точка в одній з цих областей зображує відповідне однофазное стан речовини (весь час маються на увазі тільки рівноважні стану, т. Е. Такі стани, в яких речовина при незмінних зовнішніх умовах перебуває як завгодно довго). Будь-яка точка, лежачи-щая на одній з розмежовують області кривих, зображує стан рівноваги двох відповідних фаз речовини. Потрійна точка зображує стан рівноваги всіх трьох фаз.
Таким чином, кожна точка на діаграмі зображує певний рівноважний стан речовини. Тому її називають діаграмою стану.
Діаграма стану, що будується основі експериментальних даних, дозволяє судити, в якому стані знаходиться дана речовина за певних р і Т, а також які фазові переходи будуть відбуватися при тому чи іншому процесі. Наприклад, за умов, відповідних точці 1 (рис. 47а), речовина знаходиться в твердому стані, точці 2 - в газоподібному, а в будь-якій точці, що лежить на кривій плавлення - одночасно в рідкому і твердому станах. Припустимо, що речовина в твердому стані, відповідному точці 1, піддається Ізобаричний нагрівання, зображеному на діаграмі стану горизонтальної штриховий прямий 1 -2. З малюнка видно, що при температурі, що відповідає перетинанню штриховий прямий з кривою плавлення, речовина плавиться, при більш високій температурі, відповідної перетинанню прямо 1-2 з кривою випаровування, починає перетворюватися в газ. Якщо ж речовина знаходиться в твердому стані, відповідному точці 3, то при изобарном нагріванні (штрихова пряма 3-4) кристал перетворюється в газ минаючи рідку фазу. Якщо діаграма стану має вигляд, зображений на рис. 47б. то при ізотермічному стисканні від стану 1 до стану 2 речовина з газової фази перейде в тверду, а потім в рідку.
Крива випаровування закінчується в критичній точці К. Тому можливий безперервний перехід речовини з рідкого стану в газоподібний і назад в обхід критичної точки. без перетину кривої випаровування (перехід 3-4 на рис. 47б), т. е. такий перехід, який не супроводжується фазовими перетвореннями. Це можливо завдяки тому, що відмінність між газом і рідиною є суто кількісним (обидва ці стани, наприклад, є ізотропним). Перехід же кристалічного стану (характеризується анізотропією) в рідке або газоподібне може бути тільки стрибкоподібним (в результаті фазового переходу), тому криві плавлення і сублімації не можуть обриватися, як це має місце для кривої випаровування в критичній точці. Крива плавлення йде в нескінченність, а крива сублімації йде в точку, де р = 0 і T = 0.