Ще в середні століття хіміки звернули увагу, що деякі хімічні елементи схожі один на одного по ряду властивостей і за складом утворених ними сполук. Поступово зі всієї безлічі елементів вдалося виділити природні сімейства. об'єднують родинні елементи. Такими стали, наприклад, сімейство лужних металів і сімейство галогенів. Протягом XIX століття виявлялися все нові і нові закономірності у властивостях елементів, і хіміки стали робити спроби поєднати в одну систему все безліч відомих елементів.
Натуральний ряд хімічних елементів, в якому вони впорядковані за зростанням атомного номера Z, великому вченому вдалося отримати, виходячи з значень атомних мас елементів, які в цьому ряду також, як правило, зростають. Спираючись на періодичність властивостей, що спостерігалася в натуральному ряду, Д. І. Менделєєв сформулював періодичний закон і завершив систематизацію елементів. Сучасна формулювання періодичного закону така: «Властивості хімічних елементів, а також склад і властивості їх сполук перебувають у періодичній залежності від заряду атомних ядер».
Геніальність відкриття Д. І. Менделєєва полягає в тому, що вченому вдалося вловити природність взаємозв'язку атомного номера і хімічних властивостей, не маючи ніякої можливості її пояснити, так як нічого в той час не було відомо ні про атомні ядрах, ні про електронні оболонках, ні про валентних електронах.
Так народилася періодична система хімічних елементів. охоплює і систематизує всі елементи без винятку. Відомо величезне число варіантів графічного відображення цієї системи, але найбільш часто зустрічається табличний варіант. Його сучасний вигляд представлений на наступному малюнку.
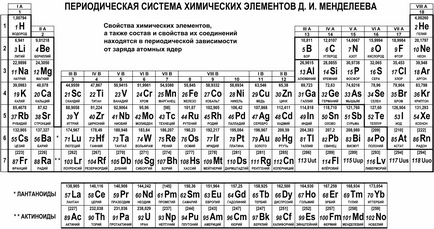
Натуральний ряд хімічних елементів розташований в таблиці Менделєєва в сім горизонтальних рядків, які називаються періодами і нумеруються цифрами від 1 до 7 (лантаноїди і актиноїди належать шостому і сьомому періоду відповідно і винесені окремими рядками з міркувань зручності). Перші три періоди називають малими. тому що вони містять невелику кількість елементів (2 або 8); інші періоди називають великими. так як в кожному з них розташована велика кількість елементів (18 або 32).
Природні сімейства елементів виявляються розташованими в вертикальних шпальтах таблиці - групах. Крім наскрізної нумерації груп числами від 1 до 18, використовується позначення римськими цифрами від I до VIII та літерами A (головна) або B (побічна). Наприклад, сімейство лужних металів (Li, Na, K, Rb, Cs, Fr) виявляється в групі IA, а так звані монетні метали (Cu, Ag, Au) - в групі IB; сімейство галогенів (F, Cl, Br, I, At) належить групі VIIA, а благородні гази (He, Ne, Ar, Kr, Xe, Rn) відносяться до групи VIIIA.
Цікаво знати! Початковий варіант таблиці елементів включав вдвічі менше число елементів, і деякі з них розташовувалися по-іншому. У міру відкриття нових елементів і розвитку уявлень про будову атома періодична система уточнювалася і розвивалася, і історія ця налічує безліч загадок і відкриттів. Навіть в даний час стан деяких елементів в системі продовжує уточнюватися: наприклад, сімейства лантаноїдів і актиноїдів традиційно відносять до групи IIIB разом з Лютецією (Lu) і Лоуренс (Lr), проте безпосередньо в колонку IIIB замість Lu і Lr можуть поміщати відповідно лантан (La ) і актиній (Ac).
Лише через півстоліття після відкриття періодичного закону вченим вдалося пролити світло на внутрішній устрій атома і пояснити періодичність у властивостях елементів. Завдяки успіхам фундаментальної фізики ми тепер знаємо, що причиною періодичного закону є шарувата структура електронних оболонок атомів.
У натуральному ряду хімічних елементів послідовно зростає заряд ядра Z, а значить, і число електронів в атомі. При цьому в електронному хмарі формуються шари, які послідовно заповнюються цими електронами. Після того, як на зовнішньому шарі накопичується вісім електронів (а для першого шару досить двох), починає заповнюватися наступний шар, і вже він стає зовнішнім. Таким чином, сценарій заповнення зовнішнього шару періодично повторюється. а оскільки електрони зовнішнього шару є валентними, то і хімічні властивості, і склад з'єднань також періодично повторюються при зростанні Z.
Як тільки починає заповнюватися електронами наступний шар, в таблиці Менделєєва ми переходимо на наступний рядок, тобто до наступного періоду. Тому номер періоду, в якому знаходиться елемент, дорівнює числу електронних шарів в атомі даного елемента і збігається з номером зовнішнього електронного шару. Наприклад, у елементів першого періоду (H, He) електрони формують лише перший шар; у елементів другого періоду (Li, Be, B, C, N, O, F, Ne) вони формують два шари, з яких зовнішнім є другою; і так далі.
В одну групу при цьому потрапляють елементи, у яких однакове число валентних електронів. Для елементів A-груп валентними є тільки електрони зовнішнього шару, і їх число збільшується від одного до восьми в межах кожного періоду (крім першого). Тому номер A-групи (що позначається римською цифрою), в якій знаходиться елемент, дорівнює числу електронів на зовнішньому шарі в атомі даного елемента. Єдиним винятком з цього правила є гелій: в його атомі всього два електрона на зовнішньому шарі, але його поміщають в групу VIIIA, оскільки заповнений зовнішній шар надає гелію властивості благородного газу.
Систематизуючи елементи, Д. І. Менделєєв відштовхувався в першу чергу від складу і властивостей простих речовин і сполук з киснем і воднем. Ці сполуки багато в чому характеризують природу елемента, тому їх часто називають характеристичними сполуками. До них традиційно відносять оксиди, гідроксиди та водневі сполуки. На прикладі елементів третього періоду можна простежити, як число валентних електронів впливає на склад і властивості цих сполук (аргон їх не утворює і тому в таблиці не включений):