При зануренні металевої пластинки, вільної від оксидної плівки, в розчин електроліту на межі метал - розчин електроліту виникає подвійний електричний шар (ДЕС), що характеризується певною різницею потенціалів або певним електродним потенціалом.
ДЕСвознікает в результаті переходу заряджених частинок через кордон розділу двох фаз метал (М), тверда фаза (т) - розчин електроліту (ж). При його формуванні, наприклад, в разі металевої пластинки, зануреної в воду, протікають наступні процеси:
1. Відрив позитивно заряджених іонів (катіонів) від поверхні металу і перехід їх в розчин.
2. Надлишок електронів, що залишаються в металі, заряджає його поверхню негативно.
3. Гідратація катіонів полярними молекулами води, в обсязі рідкої фази (сольватация молекулами розчинника)
М + nH O → М · nH O
Вище перераховані процеси (1,2,3) протікають одночасно і тому їх загальне рівняння можна записати:
4. Концентрація гідратованих (сольватованих) катіонів в прилеглому до поверхні металу шарі рідини внаслідок їх взаємодії з негативно зарядженою поверхнею. Позитивно заряджені катіони притягуються негативно зарядженою поверхнею. Формується ДЕС, що характеризується електродним потенціалом.
5. З ростом стрибка потенціалу між металом і розчином електроліту все з більшою швидкістю починають протікати зворотні процеси, дегідратація іонів металу і їх подальше відновлення до атомів.
6. При деякому стрибку потенціалу настає рівновага:
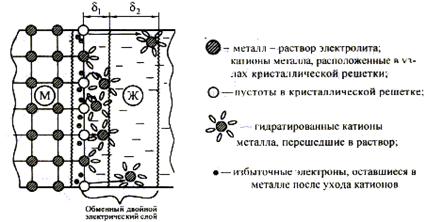
Мал. 12. Схема виникнення обмінного подвійного електричного шару та електродного потенціалу на межі метал-розчин електроліту.
Рівноважний електродний потенціал (або просто електродний потенціал) - це стрибок потенціалу, сталий між металом розчином електроліту в умовах рівноваги.
Величина електродного потенціалу, а також товщина подвійного електричного шару залежать від природи металу, температури і активності (концентрації) іонів в розчині. ДЕС має дифузне будова, тому абсолютне значення електродного потенціалу визначити неможливо. Однак, якщо використовувати електрод порівняння, потенціал якого умовно прийнятий рівним нулю (Е1 = 0 (В)), можна обчислювати електродні потенціали невідомих напівелементів (Е2), щодо електрода порівняння за допомогою рівняння: Е.Д.С. (DЕ) = Е1 - Е2.
На практиці користуються відносним (умовним) значенням рівноважного електродного потенціалу. позначається.
Стандартний відносний електродний потенціал - це величина рівна електрорушійної силі електрохімічної комірки, складеної з електрода, опущеного в розчин з активністю іонів металу, що дорівнює 1 моль / л при 25 0 С (298К), при Р = 1.03.10 5 Па, і електрода порівняння.
Як електрод порівняння використовують стандартний водневий електрод (рис.2). Конструктивно він складається з платинової пластинки (покритої шаром електролітичної платини - платинової черню), частково зануреної в розчин, що містить іони водню (зазвичай розчин H2 SO4 або HCl). До платівці подається чистий газоподібний водень під постійним тиском. У кислому середовищі водневого електроду H3 O + / H2. Pt відповідає рівняння електродного процесу 2H3 O + (ж) +2 H2 (Г) + 2H2 O (ж). яке в спрощеному вигляді записується: 2Н + (ж) +2 H2 (Г).
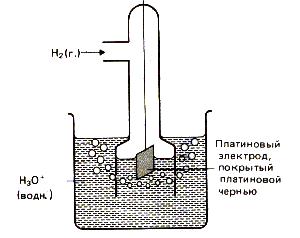
Рис.13. Водневий електрод.
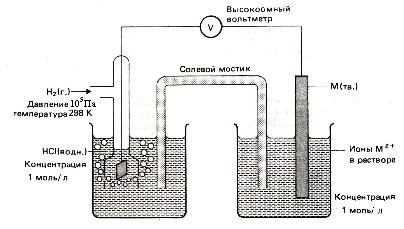
Рис.14. Вимірювання стандартних електродних потенціалів
У схематичною записи водневий електрод представляють так:, якщо платина служить анодом або
, якщо платина служить катодом.
Використання водневого електрода дозволяє виміряти відносний електродний потенціал будь-якого напівелементу, складаючи з його допомогою хімічне джерело струму (рис.3).
Якщо водневий електрод відіграє роль негативного електрода, схематичний запис складеного таким чином хімічного джерела струму має вигляд: А - PtêH2 (г) êН + (ж) êêМ n + (ж) êМ (т) К +. отже,
Якщо водневий електрод відіграє роль позитивного електрода. А - М (т) êМ n + (ж) êê Н + (ж) ê H2 (г) ê Pt До +. то.
Таким чином, електродний потенціал розглянутого напівелементу дорівнює стандартній е.р.с. хімічного джерела, що складається з цього напівелементу і стандартного водневого електрода.
У нестандартних умовах електродний потенціал розраховують за рівнянням Нернста:
(ОФ) - окислена форма;
(ВФ) - відновлена форма;
R = 8.314 Дж / К. моль (універсальна газова постійна);
Е 0 -відносний електродний потенціал (табличні дані); вимірюється в вольтах (В);
Т-абсолютна температура (298К);
F-число Фарадея, рівне 96500 (Кл / моль);
n-число електронів, що беруть участь в процесі;
З-молярна концентрація катіонів металу (моль / л).
Е = Е 0 + 0.059 / n. lgCMe n +, якщо CMe n + = 1 моль / л, то Е = Е 0.
Завдання. Обчислити електродний потенціал золотий пластини, опущеною в розчин солі з концентрацією [Au 3+], що дорівнює 0,1 моль / л.
Оскільки умови, описувані в завданню, відрізняються від стандартних, тобто СAu 3+ ¹1 моль / л, а становить 0,1 моль / л за умовою завдання, отже, для розрахунку електродного потенціалу необхідно використовувати рівняння Нернста:
Поняття електродний потенціал введено для того, щоб можна було порівняти окислювально-відновні властивості різних систем за їх стандартним потенціалом.
У відповідності зі значеннями стандартного електродного потенціалу був складений електрохімічний ряд напруг металів.
K Ca Mg Al Zn Fe Pb H + Cu Ag Au
1.Все метали, що стоять лівіше водню. мають негативні значення стандартних електродних потенціалів. правіше позитивними .Соглашеніе про знаках потенціалів було прийнято в 1953р. на конгресі Міжнародного союзу теоретичний і прикладної хімії (ІЮПАК). Домовилися приписувати потенціалу той знак. який має електрод в парі зі стандартним водневим електродом.
2. Негативні значення свідчать, що дані метали є відновниками по відношенню до водню, тобто витісняють (відновлюють його з розчинів мінеральних кислот з = 1 моль / л, аніони яких не виявляють окисних властивостей (HCl. разб.H SO))
Zn + 2HCl → ZnCl + H ↑; E 0 Zn n + / Zn = -0.763 B
і розкладають воду
3. Чим більше негативно значення електродного потенціалу, тим вище здатність металу віддавати свої іони в розчин, тобто тим сильніше виражена відновна здатність його відновленої форми (здатність віддавати електрони) і нижче окислювальна здатність його окисленої форми (здатність приймати електрони).
4.Положітельное значення потенціалу означає, що дані іони металів є окислювачами по відношенню до водню, тобто розкладають воду і не витісняють його з розчинів, у яких = 1 моль / л. Навпаки, водень витісняє метали з розчинів їх солей.
5. Серед металів з позитивним значенням стандартного електродного потенціалу, кожен попередній метал витісняє всі наступні з розчинів їх солей. Наприклад: Cu + HgCl2 → CuCl2 + Hg.