де δ Q i = δ Q 1 i + δ Q 2 i - кількість теплоти, отримане робочим тілом на двох ізотермічних ділянках при температурі T i. Для того, щоб такий складний цикл провести оборотним шляхом, необхідно робоче тіло приводити в тепловий контакт з багатьма тепловими резервуарами з температурами T i. Ставлення δ Q i / T i називається наведеним теплом. Отримана формула показує, що повне наведене тепло на будь-якому оборотному циклі дорівнює нулю. Ця формула дозволяє ввести нову фізичну величину, яка називається ентропією і позначається буквою S (Р.Клаузиус, 1865 г.). Якщо термодинамічна система переходить з одного рівноважного стану в інший, то її ентропія змінюється. Різниця значень ентропії в двох станах дорівнює наведеним тепла, отриманого системою при оборотному переході з одного стану в інший.
В разі оборотного адіабатичного процесу δ Q i = 0 і, отже, ентропія S залишається незмінною.
Вираз для зміни ентропії δ S при переході неізольованою системи з одного рівноважного стану (1) в інший рівноважний стан (2) може бути записано у вигляді
Ентропія визначена з точністю до постійного доданка, так само, як, наприклад, потенційна енергія тіла в силовому полі. Фізичний сенс має різницю δ S ентропії в двох станах системи. Щоб визначити зміну ентропії в разі незворотного переходу системи з одного стану в інший, потрібно придумати якийсь оборотний процес, що зв'язує початкове і кінцеве стану, і знайти наведене тепло, отримане системою при такому переході.
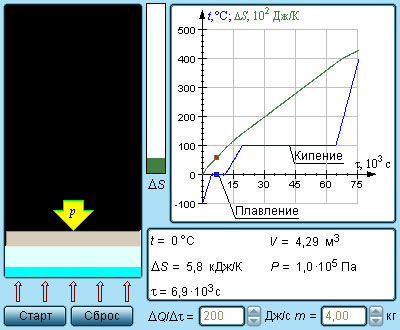
Модель. Ентропія і фазові переходи
Мал. 3.12.4 ілюструє необоротний процес розширення газу «в порожнечу» за відсутності теплообміну. Тільки початковий і кінцевий стани газу в цьому процесі є рівноважним, і їх можна зобразити на діаграмі (p. V). Точки (a) і (b), які відповідають цим станам, лежать на одній изотерме. Для обчислення зміни δ S ентропії можна розглянути оборотний ізотермічний перехід з (a) в (b). Оскільки при ізотермічному розширенні газ отримує деяку кількість теплоти від оточуючих тел Q> 0. можна зробити висновок, що при незворотному розширенні газу ентропія зросла: δ S> 0.
Розширення газу в «порожнечу». Зміна ентропії де A = Q - робота газу при оборотному ізотермічному розширенні
Інший приклад незворотного процесу - теплообмін при кінцевій різниці температур. На рис. 3.12.5 зображені два тіла, укладені в адіабатичну оболонку. Початкові температури тел T 1 і T 2
Теплообмін при кінцевій різниці температур: a - початковий стан; b - кінцевий стан системи. Зміна ентропії δ S> 0
Зростання ентропії є загальною властивістю всіх мимовільно протікають необоротних процесів в ізольованих термодинамічних системах. При оборотних процесах в ізольованих системах ентропія не змінюється:
Це співвідношення прийнято називати законом зростання ентропії.
При будь-яких процесах, що протікають в термодинамічних ізольованих системах, ентропія або залишається незмінною, або збільшується.
Таким чином, ентропія вказує напрямок мимовільно протікають процесів. Зростання ентропії вказує на наближення системи до стану термодинамічної рівноваги. У стані рівноваги ентропія приймає максимальне значення. Закон зростання ентропії можна прийняти в якості ще одного формулювання другого закону термодинаміки.
У 1878 році Л. Больцман дав вірогідну трактування поняття ентропії. Він запропонував розглядати ентропію як міру статистичного безладдя в замкнутій термодинамічній системі. Всі мимоволі протікають процеси в замкнутій системі, що наближають систему до стану рівноваги і супроводжуються зростанням ентропії, спрямовані в бік збільшення ймовірності стану.
Будь-яке стан макроскопічної системи, що містить велику кількість частинок, може бути реалізовано багатьма способами. Термодинамічна ймовірність W стану системи - це число способів. якими може бути реалізовано дане стан макроскопічної системи, або число микросостояний. здійснюють дане макросостояніе. За визначенням термодинамічна ймовірність W >> 1.
Наприклад, якщо в посудині знаходиться 1 моль газу, то можливо величезне число N способів розміщення молекули по двох половинок посудини: де - число Авогадро. Кожен з них є микростанів. Тільки одне з микросостояний відповідає випадку, коли всі молекули зберуться в одній половинці (наприклад, правої) судини. Імовірність такої події практично дорівнює нулю. Найбільше число микросостояний відповідає рівноважного стану, при якому молекули рівномірно розподілені по всьому об'єму. Тому рівноважний стан є найбільш вірогідним. З іншого боку рівноважний стан є станом найбільшого безладдя в термодинамічній системі і станом з максимальною ентропією.
Згідно Больцману, ентропія S системи і термодинамічна ймовірність W пов'язані між собою в такий спосіб:
де k = 1,38 · 10 -23 Дж / К - постійна Больцмана. Таким чином, ентропія визначається логарифм числа микростанів. за допомогою яких може бути реалізовано дане макросостояніе. Отже, ентропія може розглядатися як міра ймовірності стану термодинамічної системи.
Імовірнісна трактування другого закону термодинаміки допускає мимовільне відхилення системи від стану термодинамічної рівноваги. Такі відхилення називаються флуктуаціями. У системах, що містять велику кількість частинок, значні відхилення від стану рівноваги мають надзвичайно малу ймовірність.