Двохатомні гомоядерних молекули [c.49]
Молекули Oj, Nj і I2, що складаються з атомів лише одного сорту, називаються гомоядерних. На відміну від цього такі молекули. як, наприклад, НС1, СО або HI, називаються гетероядерні. Спробуємо поширити описаний вище простий підхід до розгляду молекул Н, і H j, заснований на теорії молекулярних орбіталей. на гомоядерних двоатомних молекули елементів другого періоду. Деякі з таких молекул. наприклад Nj, Oj і Fj, стійкі при нормальних умовах. Інші, наприклад С або Lij, виявляються тільки при високих температурах. а треті вообше не існують. Як пояснює ці факти теорія молекулярних орбіталей [c.520]
При взаємодії атомів утворюються молекули гомоядерних (при взаємодії атомів одного елемента) або гетероядерні (при взаємодії атомів різних елементів). [C.17]
Заповнення орбіталей електронами здійснюється точно так же, як і в разі гомоядерних молекул. Молекула ВИ ізоелектронними з С2 відмінність між ними полягає головним чином в тому, що рівні і [c.538]
Легко бачити, що ці комбінації лінійно незалежні. Розглянемо комбінації XI і 2. Як видно з рис. 4.3, результуючі функції виглядають як видозмінені р-АТ з одним великим і однієї невеликої лопатями у Х1 і / 2 великі лопаті спрямовані по осі 2 в протилежні сторони. Будемо вважати розглянуту молекулу гомоядерних, так що в наближенні Хюккеля обидві 2з-АТ мають однакові кулонівських ін- [c.172]
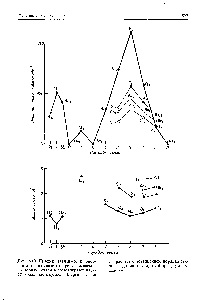
Електронна будова гомоядерних двоатомних молекул визначається шляхом уявного процесу заповнення валентними електронами молекулярних орбіталей. починаючи від а, і кінчаючи а. в порядку зростання енергії. Таким чином, можна встановити, наприклад, що молекула И2 має електронну конфігурацію КК (а) (одна а-зв'язок), а молекула N2 має конфігурацію КК (а,) (ст) (Лд. У) (а,) з трьома ефективними зв'язками (одна ст-зв'язок і дві л-зв'язку). Ефективне число зв'язують електронів, поділене на 2, дає умовний порядок зв'язку. Наприклад, у молекули И2 порядок зв'язку 1, а N3 має порядок зв'язку 3. У міру зростання порядку зв'язку в заданій гомоядерних двухатомной системі довжина зв'язку уменьщается, а енергія зв'язку збільшується. [C.544]
Набір можливих обертальних станів залежить від того, чи є молекула гомоядерних Н. О) або гетероядерні (НС1). Тому розглянемо окремо обидва випадки. [C.246]
Єдино можливе коливання в двухатомной молекулі є рух атомів уздовж осі, що з'єднує обидва ядра. Якщо молекула гомоядерних (О2, I2 і т. Д.), Очевидно, що центри позитивних і негативних зарядів у всіх фазах коливання збігаються і дипольний момент завжди дорівнює нулю. Коливання таких молекул не супроводжуються поглинанням інфрачервоного випромінювання і називаються неактивними в інфрачервоному спектрі. З іншого боку, якщо атоми в молекулі різні (НС1, СО і т. Д.), Електронний розподіл при коливанні валентного зв'язку змінюється. При цьому центри позитивних і негативних зарядів не завжди збігаються, в результаті чого дипольний момент змінюється. Подібні коливання називають активними. Вони можуть взаємодіяти з електромагнітним випромінюванням, піт [c.13]
Мал. 3. розпушують (а) і зв'язує (б) хвильові функції гомоядерних двоатомних молекули

Дослідження електронної будови гетероядерних двоатомних молекул загального вигляду АВ проводиться подібно до того, як це робилося для гомоядерних молекул. В тому і іншому випадку виходять подібні орбітально-енергетичні діаграми. лише з тією різницею, що орбітальні рівні більш електронегативного атома розташовані глибше, ніж у менш електронегативного атома (рис. 12-13). Отже, що зв'язують молекулярні орбіталі містять переважаючий вклад більш електронегативного атома. а розпушують орбіталі-преобладаю- [c.537]
Чому зображення орбіталей для гетероядерні двоатомних молекули на рис. 12-14 відрізняються від відповідних зображень для гомоядерних двоатомних молекул на рис. 12-7 [c.546]
Які двоатомних молекули називаються гомоядерних і які гетероядерні [c.545]
У переважній більшості випадків основною терм двоатомних молекули - це а для гомоядерних молекул Є й винятки, наприклад [c.198]
Ентропія зростає, тому що молекули продукту складніше (вони гетероядерні), ніж молекули реагентів (гомоядерних). Однак це збільшення ентропії невелика. [C.532]
Нижче як приклад ми розглянемо молекули, що належать точковій групі симетрії До їх числа відносяться все двоатомні гомоядерних і багатоатомні гетероядерні лінійні структури з центром інверсії НС СН, 0 = С = 0 і т. Д. [C.192]
Рис, 1. Відносне розташування молекулярних орбіталей по ен1 ргіям гомоядерних двоатомних молекул без взаємодії а, - і - МО (а) і з взаємодією (б) [c.11]
Книга всебічно і дохідливо, а найголовніше методологічно правильно знайомить з теорією хімічного зв'язку і результатами її застосування до опису будови і властивостей сполук різних класів. Спочатку викладені доквантовие ідеї Дж. Льюїса про валентні (льюїс ових) структурах і показано, що вже на основі уявлень про усуспільнення електронних пар і простого правила октету за допомогою логічних міркувань про кратності зв'язків і формальних зарядах на атомах вдається без складних математичних викладок, як то кажуть на пальцях. пояснити будову і властивості багатьох молекул. По суті, з цього починається ознайомлення з пронизливими всю сучасну хімію поглядами і термінами одного з двох основних підходів в квантової теорії хімічної будови-методу валентних зв'язків (ВС). На жаль, незважаючи на простоту і інтуїтивну привабливість цих уявлень, метод ВС дуже складний в обчислювальному відношенні і не дозволяє на якісному рівні вирішувати питання про енергетику електронних станів молекул. без чого не можна судити про їх будову. Тому далі квантова теорія хімічного зв'язку викладається, в основному, в рамках іншого підходу -методу молекулярних орбіталей (МО). На прикладі двоатомних молекул вводяться найважливіші уявлення теорії МО про орбітальному перекривання і енергетичних рівнях МО, їх пов'язує характер і вузлових властивості. а також про симетрії МО. Все це завершується побудовою узагальнених діаграм МО для гомоядерних і Гете -роядерних двоатомних молекул і обговоренням з їх допомогою будови і властивостей багатьох конкретних систем попутно з'ясовується, що деякі властивості молекул (наприклад, магнітні) вдається пояснити тільки на основі квантової теорії МО. Далі теорія МО застосовується до багатоатомним молекулам. причому в одних випадках це робиться в термінах локалізованих МО (схожих з уявленнями про спрямованих зв'язках методу ВС) і для їх конструювання вводиться гібридизація атомних орбіталей. а в інших-доводиться звертатися до делокалізованних МО. Обговорення всіх цих питань завершується цікаво написаним розділом про можливості молекулярної спектроскопії при встановленні будови сполук тут пояснюються принципи колебательной спектро- [c.6]
Для двухатомного гомоядерних речовини обертальна сума по станах Q = 50. Обчисліть для -го рівня 1) відношення числа молекул на -му рівні до числа молекул на нульовому рівні 2) частку (від загального числа) молекул, що знаходяться на 1-му рівні 3) частку молекул, що знаходяться на нульовому рівні. [C.123]
На схемі () наведені послідовні етапи ускладнення хімічної організації матерії (природно, що наведена схема є одночасно і фрагментом загальної структ и організації матерії, т. Е. Продовженням схеми). Зі схеми (2) видно, що молекулярні асоціати утворюються з гомоядерних або гетеро-ядерних молекул, в той час як атомні асоціати утворюються з атомних частинок. минаючи другий, молекулярний рівень. Освіта атомних агрегатів може відбуватися вже по двох незалежних механізмів або безпосередньо з атомних частинок (минаючи два рівня), або за рахунок взаємодії атомних ассоциатов. Найбільш характерними прикладами атомних агрегатів є атомні і металеві кристалічні решітки [c.9]
Почнемо тепер послідовно заселяти електронами молекулярні орбіталі -по два електрона на орбиталь-і таким чином з'ясуємо електронна будова гомоядерних двоатомних молекул від Li2 до N62- У всіх цих молекулах є перш за все чотири електрона, які в ізольованих атомах знаходилися на внутрішніх 15 -орбіталі 51х. У двухатомной молекулі два з цих чотирьох внутрішніх електронів перебувають на зв'язує молекулярної орбіталі а1 а два-на розпушують орбіталі а. Однак ці чотири електрона не роблять ніякого впливу на хімічний зв'язок. і тому можна вважати, що вони як і раніше знаходяться на атомних 1х-орбіталях. Хімічна зв'язок в розглянутих тут молекулах визначається тільки зовнішніми електронами з атомних рівнів з квантовим числом п = 2, тому необхідно розглядати тільки ті молекулярні орбіталі. які утворені атомними 2з-і 2р-орбіталей. [C.525]
Квадрати цих функцій визначають розподілу електронної щільності. відповідні кожної молекулярної орбіталі. Все щести молекулярних орбіталей схематично зображено на рис. 13-25. Три з них є що зв'язують, а три-розпушують. Їх енергетичні рівні показані на рис. 13-26. Відзначимо, що на прикладі розглянутих я -орбіталей ілюструється загальне правило. згідно з яким орбіталі з больщім числом вузлових поверхонь мають більш високу енергію. Справедливість цього твердження можна перевірити на орбіталях гомоядерних і гетероядерних двоатомних молекул. обсуждавщіхся в гл. 12, і навіть на хвильових функціях атома водню. [C.575]
У Г.Т. 12 ми обговорювали електронна будова НС1 п відзначали, що гетероядерні двоатомних молекули полярні, тоді як гомоядерних дву.чатомние молекули неполярні. Неполярная молекула має нульовий (або близький до нуля) дипольний момент. Серед багатоатомних молекул є чимало такі.х, в яких окремі зв'язку полярні. хоча молекула в цілому неполярная. Як приклад наведемо ССЦ. Будова молекули lj. показано на рис. 13-28, а. Оскільки хлор-більш електронегативний елемент. ніж вуглець, що зв'язують електронні пари зміщуються в напрямку до атомів хлору. В результаті кожна зв'язок С-С набуває невеликий дипольний% юмент. Попарне векторне складання диполів зв'язків дає два рівних по величині і зворотних у напрямку диполя фрагментів СС1. як показано на рис, 13-28, б. Симетрична тетраедричних форма молекул ССЦ обумовлює її нульовий дипольний момент таким чином, I4-неполярная молекула. [C.579]
Валентність і будова молекул (1979) - [c.66. c.72]