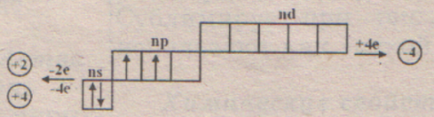
На зовнішньому шарі 4 електрона, шар не завершений, але заповнений на половину. Радіус атома кремнію більше ніж у вуглецю, ці валентні електрони перебувають далі від ядра, ніж в атомі вуглецю => ЕО невисока; кремній - неметалл, але нетиповий. У збудженому стані у нього два неспарених електрона, але валентність II кремній в сполуках не проявляє. Наявність вільної р-орбіталі уможливлює перехід S-електрона на неї і поява чотирьох неспарених e -. і => характерною для нього валентності - (IV). Можлива негативна С.О. -4, вона проявляється в сполуках з металами - силіциди. Але це формально. В реальності складу багатьох з них змінний і не відповідає звичайним ступенями окислення. У шкільній програмі силіциди не вивчаються. У всіх з'єднаннях з неметалами кремній проявляє ступінь окислення +4. Найпростіше ЛВС - силан SiН4. дуже нестійкий. А
ось оксид SiO2 і все солі кремнієвої кислоти - навпаки дуже міцні з'єднання.
Поширення в природі: кремній становить приблизно 28% від маси земної кори, тобто по поширенню на Землі поступається тільки кисню. Зустрічається тільки у вигляді різних кисневих з'єднань - оксид і силікати. Земна кора більш ніж наполовину складається саме з цих сполук. Це пояснюється здатністю атомів кремнію утворювати особливо міцні зв'язки з киснем.
8. Проста речовина. Для кремнію можлива аллотропия як і для вуглецю, але графітоподібний (аморфна) модифікація (порошок коричневого кольору) вкрай нестійка при н.у.
Алмазоподібні модифікація кремнію. кристалічна решітка - атомна, всі чотири зв'язку однакові і спрямовані до вершин тетраедра. Тверде дрібні кристали темно-сірого кольору з металевим блиском. У природі не зустрічаються. Кристали тугоплавкі (+1428 ° С), дуже тверді, але крихкі; у воді не розчиняються. Кристалічний кремній - напівпровідник, його електропровідність значно зростає при освітленні або нагріванні. Його провідність дуже сильно залежить від наявності певних домішок (наприклад, домішки Р дають п-Si, а додавання В дають р-Si. Кремній як напівпровідник широко використовується в мікроелектроніці.

Як окислювач кремній взаємодіє з металами:
Si + Са → Са2 Si (силицид кальцію), при підвищеній температурі
Як відновник, кремній при нагріванні взаємодіє з киснем та іншими активними неметалами, з оксидами. Ці реакції протікають набагато легше, тобто відновні властивості для нього більш характерні, ніж окисні. наприклад:
2) Si + С → siс (карборунд - прозорі, дуже тверді кристали, з високим коефіцієнтом заломлення і хімічно стійкі, схожі на алмаз або монокристал оксиду алюмінію. З нього виготовляють шліфувальний папір і кола, плити для підлоги, футерування печей)
З'єднання кремнію з воднем не можна отримати при безпосередній взаємодії простих речовин. Їх загальна назва - силани. Вони дуже летючий, мають дуже неприємний запах, легко розкладаються, самовоспламеняются на повітрі.
Отримання. З кварцового піску при високій температурі кремній відновлюється активними металами або коксом. Але такий кремній не проводить електричний струм, тому що він містить 5-3% домішок. Для потреб радіоелектроніки отриманий кремній очищають спеціальними методами (зонної плавкою).
1. Монокристали кремнію з відповідними добавками служать для виготовлення фотоелементів (сонячні батареї та інше ...), діодів і тріодів (випрямлячі і підсилювачі в електричних пристроях). 2. У металургії кремній використовують для «розкислення» сталей і надання їм підвищеної корозійної стійкості.
9. З'єднання кремнію з негативною ступенем окислення. Силіциди (з'єднання кремнію з активними металами) використовуються для отримання жаростійких і кислототривких сплавів, високотемпературних напівпровідникових матеріалів.
10. Набагато частіше і в природі, і на виробництві ми маємо справу з кисневими сполуками кремнію в яких він має стійку позитивну ступінь окислення.


Особливою різновидом кварцу є кремінь. мінеральне утворення, що складається з кристалічного і аморфного кремнезему (SiO2) в осадових гірських породах. Часто пофарбований оксидами заліза і марганцю в різні кольори. Це непрозора, дуже тверда гірська порода, що дає гострі відколи. Стародавні люди використовували її для отримання вогню і виготовлення знарядь праці.
Кристали кварцу мають високий коефіцієнт заломлення світла, пропускають ультрафіолетові промені, тому їх використовують в оптичних приладах. З них часто виготовляють ювелірні вироби, що імітують (досить успішно) діаманти. А ще монокристали кварцу мають п'єзоелектричним ефектом (тобто ефект виникнення поляризації діелектрика під дією механічної напруги (і навпаки)). Цей ефект використовують в акустичних приладах, П'єзозапальнички і пральних машинках ...
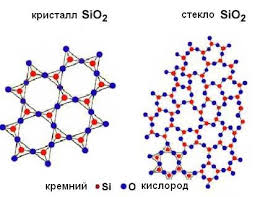
Оксид кремнію хімічно інертний, в воді не розчиняється. Але при сплаву він взаємодіє з лугами, тобто оксид кремнію є кислотним оксидом.
При високих температурах окисляє активні метали, тобто може проявляти окисні властивості. але слабо:
Mg + SiО2 → MgО + Si
Особливим хімічним властивістю оксиду кремнію є його здатність розчинятися в плавикової кислоті. Цей процес використовують для травлення скла.
1). пісок - в будівництві;
2). пісок - у виробництві скла;
3). пісок - в керамічній промисловості (фарфор, фаянс, цегла);
4). пісок - у виробництві цементу;
5). монокристали - в радіотехніці і радіоелектроніка (випрямлячі і підсилювачі, звукозаписувальна та звуковідтворювальна апаратура), приладобудуванні (ультразвукові прилади: колоїдні млини, пральні машини, УЗД і т.д.);
6). кварцове скло - оптичні і хімічні прилади
7). в аморфному вигляді - як осушувачі і адсорбенти.