Загальна характеристика кисню
Кисень - восьмий елемент періодичної таблиці. Позначення - Про від латинського «oxygenium». Розташований у другому періоді, VIа групі. Відноситься до неметалів. Заряд ядра дорівнює 8.
Кисень - найпоширеніший елемент земної кори. У вільному стані він знаходиться в атмосферному повітрі, у зв'язаному вигляді входить до складу води, мінералів, гірських порід і всіх речовин, у тому числі побудовано організми рослин і тварин. Масова частка кисню в земній корі становить близько 47%.
У вигляді простого речовини кисень являє собою безбарвний газ, який не має запаху. Він трохи важчий за повітря: маса 1 л кисню при нормальних умовах дорівнює 1,43 г, а 1 л повітря 1,293г. Кисень розчиняється у воді, хоча і в невеликих кількостях: 100 обсягів води при 0 o С розчиняють 4,9, а при 20 o С - 3,1 обсягу кисню.
Атомна і молекулярна маса кисню
Відносна атомна маса Ar - це молярна маса атома речовини, віднесена до 1/12 молярної маси атома вуглецю-12 (12 С).
Відносна атомна маса атомарного кисню дорівнює 15,999 а.е.м.
Відносна молекулярна маса Mr - це молярна маса молекули, віднесена до 1/12 молярної маси атома вуглецю-12 (12 С).
Це безрозмірна велічіна.Ізвестно, що молекула кисню двоатомних - О2. Відносна молекулярна маса молекули кисню буде дорівнює:
Аллотропия і аллотропние модифікації кисню
Кисень може існувати у вигляді двох аллотропних модифікацій - кисню О2 і озону О3 (фізичні властивості кисню описані вище).
При звичайних умовах озон - газ. Від кисню його можна відокремити сильним охолодженням; озон конденсується в синю рідину, що кипить при (-111,9 o С).
Розчинність озону в воді значно більше, ніж кисню: 100 обсягів води при 0 o С розчиняють 49 обсягів озону.
Утворення озону з кисню можна виразити рівнянням:
ізотопи кисню
Відомо, що в природі кисень може знаходитися у вигляді трьох ізотопів 16 O (99,76%), 17 O (0,04%) і 18 O (0,2%). Їх масові числа рівні 16, 17 і 18 відповідно. Ядро атома ізотопу кисню 16 O містить вісім протонів і вісім нейтронів, а ізотопів 17 O і 18 O- така ж кількість протонів, дев'ять і десять нейтронів відповідно.
Існує дванадцять радіоактивних ізотопів кисню з масовими числами від 12-ти до 24-х, з яких найбільш стабільним є ізотоп 15 Про з періодом напіврозпаду рівним 120 с.
Іони кисню
На зовнішньому енергетичному рівні атома кисню є шість електронів, які є валентними:
Схема будови атома кисню представлена нижче:
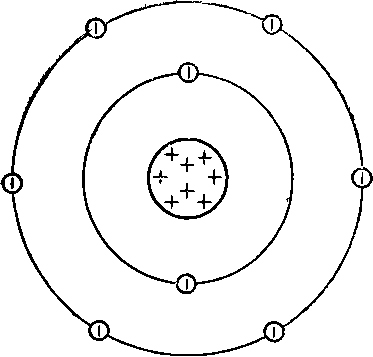
В результаті хімічної взаємодії кисень може втрачати свої валентні електрони, тобто бути їх донором, і перетворюватися в позитивно заряджені іони або приймати електрони іншого атома, тобто бути їх акцептором, і перетворюватися в негативно заряджені іони:
Про 0 + 2e → О 2;
Про 0 -1e → Про 1+.
Молекула і атом кисню
Молекула кисню складається з двох атомів - О2. Наведемо деякі властивості, що характеризують атом і молекулу кисню: