Кепірующіе білки в регуляції довжини актінових филаментов
• Кепірующіе білки інгібують елонгацію актінових филаментов
• Кепірующіе білки функціонують як на оперених так і на загострених кінцях актінових филаментов
• Кепірующіе білки і білки сімейства гельзолін пригнічують елонгацію оперених решт; в свою чергу, ця їхня здатність відзначено зниження фосфолипидами плазматичноїмембрани
• Тропомодулін є білок, який кепірует загострені кінець актинового філамента
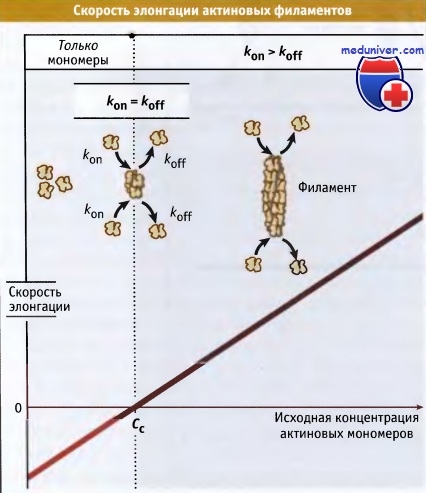
In vitro, при нерегульованому зростанні, актинові філаменти швидко і безперервно ростуть до тих пір, поки концентрація вільного мономера не досягне критичного рівня. У клітці існують спеціальні механізми, які контролюють кількість вільних оперених решт филаментов. Такий контроль необхідний для запобігання виснаженню пулу мономерного актину і для регулювання розміру специфічних актінових структур.
Оскільки короткі Актинові філаменти мають більшу твердість, ніж довгі, регуляція їх розмірів контролює механічні властивості актиновой мережі. Білки, які зв'язуються з кінцями Актинові філаментів і запобігають подальшу полімеризацію мономерів, називаються кепірующімі білками. Деякі кепірующіе білки пов'язують оперення кінці, в той час як інші асоціюють з загостреними кінцями. Білки, що утворюють кеп на оперення кінці, обмежують довжину філамента, оскільки перешкоджають елонгації. Білки, кепірующіе загострений кінець, запобігають деполимеризацию актину.
До білків, що створює кеп на оперення кінці, належать CapZ. EPS8 і представники сімейства гельзолін. Хоча кепірующіе і гельзолін-білки розрізняються по структурі і механізму дії, вони зв'язуються з оперенням кінцями филаментов і унеможливлюють подальше додавання мономерів. Ці білки мають високу спорідненість до опереним кінців филаментов і перешкоджають додаванню актінових субодиниць навіть при високій концентрації мономерів.
Рівень PIP2 змінюється в залежності від сигналу, що надходить з поверхневих рецепторів клітини, пов'язаних з одним з G-білків. Шляхом регуляції копіювання на клітинній мембрані можна контролювати елонгацію филаментов. Цей процес є ключовим в міграції клітин і протрузії мембран. Рівень активності копіюють білків може впливати на тип протрузии (ламеллоподіі або філоподіі).
Тропомодуліни представляють собою сімейство широко поширених копіюють білків. які в присутності регуляторного актинового білка тропо-міозину мають високу спорідненість до загостреним кінців актінових филаментов. Тропомодуліни контролюють довжину актінових филаментов волокон поперечно-смугастих м'язів. Вони також регулюють довжину актінових филаментов і динаміку їх складання в еритроцитах і епітеліальних клітинах
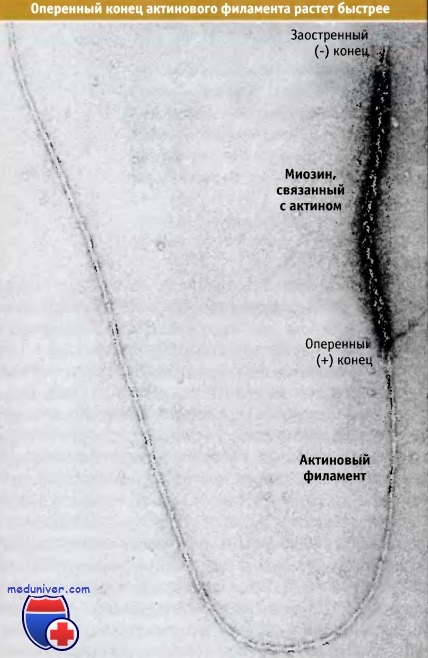
Для нуклеации процесу елонгації використовували филамент, пов'язаний з актином.
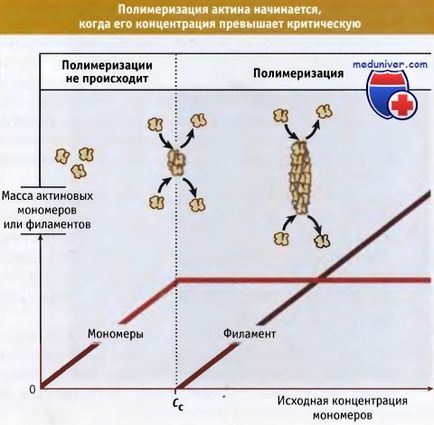
коли вихідна концентрація актінових мономерів перевищує критичну концентрацію, Сс.