Сигма-зв'язок (σ) - це зв'язок, утворена електронними хмарами по лінії, що з'єднує ядра атомів. Одинарні зв'язку завжди є σ-зв'язками.
Пі-зв'язок (π) - це зв'язок, утворена перекриванням електронних хмар по обидві сторони від лінії, що з'єднує ядра атомів.
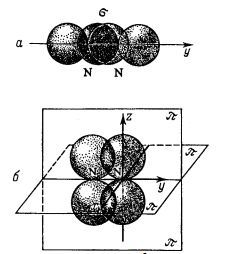
Атом азоту, що володіє електронною конфігурацією 1s ^ 2; 2s ^ 2; 2p ^ 3, має три р-орбіталі, розташовані у взаємно перпендикулярних напрямках - по осях х, у і z. Припустимо, що два атоми азоту наближаються одна до одної, рухаючись по осі У. Тоді при достатньому зближенні дві 2py-орбіталі перекриваються, утворюючи загальне електронне хмара, яке розташовується уздовж осі, що з'єднує ядра атомів (рис.). Ковалентний зв'язок, утворена електронним хмарою з максимальною щільністю на лінії, що з'єднує центри атомів, називається сигма-зв'язком.
Розглянемо, що відбувається неспареними електронами атомів азоту при їх зближенні. На рис. представлені хвильові функції 2pz-електронів атомів азоту. Їх орбіталі також перекриваються. Але на відміну від прямого перекривання орбіталей при утворенні σ-зв'язку, тут відбувається бічне перекривання. В результаті утворюються дві області перекривання, які розташовані по обидва боки від лінії, що з'єднує ядра атомів, при цьому площина, що проходить через осі z і у, є площиною симетрії областей перекривання. Ковалентний зв'язок, утворена електронами, орбіталі яких дають найбільшу перекривання по обидві сторони від лінії, що з'єднує центри атомів, називається ПІ-зв'язком.
Очевидно, що два 2px -Електронна атомів азоту утворюють другу π зв'язок, яка розташована біля площини, що проходить через осі у і х. Таким чином, в молекулі азоту є три хімічні зв'язки, проте ці зв'язки неоднакові: одна з них σ-зв'язок, а дві інші - π-зв'язку.