Хімічний склад білків.
З органічних речовин клітини на першому місці за кількістю і значенням стоять білки. До складу всіх білків входять атоми водню, кисню, азоту. У багато білків входять, крім того, атоми сірки. Є білки, до складу яких входять також атоми металів - заліза, цинку, міді.
На відміну від інших органічних сполук білки мають ряд особливостей. Перш за все білків властива величезна молекулярна маса. Порівняйте: молекулярна маса спирту - 46, оцтової кислоти - 60, бензолу - 78, а альбуміну (одного з білків яйця) - 36 000, гемоглобіну (білка з червоних кров'яних клітин) - 152 000, міозину (одного з білків м'язів) - 500 000. Ясно, що в порівнянні з молекулами спирту, оцтової кислоти, бензолу і іншими молекули білків велетні. У їх побудові беруть участь тисячі атомів. Для того щоб підкреслити гігантський розмір таких молекул, їх називають макромолекулами (грец. «Макрос» - великий, гігантський).
Будова білків.
Серед органічних сполук білки найскладніші. Вони відносяться до з'єднань, званим полімерами. Молекула полімеру являє довгий ланцюг, в якій багато разів повторюється одна і та ж порівняно проста структура, звана мономером. Якщо позначити мономер буквою А, то структуру полімеру можна зобразити так: А-А-А-А-А.
Крім білків в природі існує багато інших полімерів, наприклад целюлоза, крохмаль, каучук. У хімічній промисловості створено багато штучних полімерів - поліетилен, лавсан, капрон та ін.
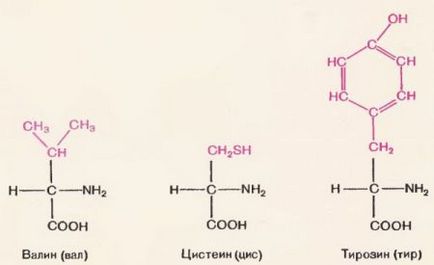
Більшість природних і штучних полімерів побудовані з однакових мономерів. Білки ж складаються з подібних, але не цілком однакових мономерів. Мономерами білків є амінокислоти. Як видно на малюнку 70, молекула амінокислоти як би складається з двох частин. Одна частина (чорними буквами) у всіх амінокислот однакова.
Це угруповання. Вона складається з аміногрупи (-NH2) і знаходиться поруч карбоксильної групи (-СООН). Інша частина молекули у всіх амінокислот різна (вона надрукована червоними літерами). Ця частина називається радикалом.
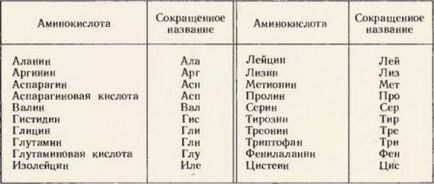
Відомо багато різних амінокислот. Але як мономерів будь-яких природних білків - тварин, рослинних, мікробних, вірусних - відомо тільки 20 амінокислот. Вони отримали назву «чарівних». Їх список представлений в таблиці.
Той факт, що білки всіх організмів побудовані з одних і тих же амінокислот - ще один доказ єдності живого світу на Землі.
Двадцять амінокислот, що входять до складу природних білків ( «чарівні» амінокислоти)
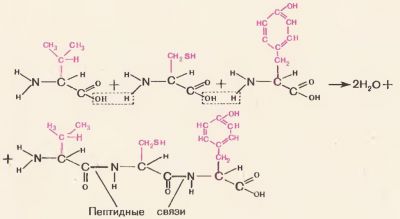
З'єднання амінокислот при утворенні білкової молекули здійснюється через загальну для всіх амінокислот угруповання. Щоб краще це зрозуміти, розгляньте малюнок 71: з карбоксильної групи однієї амінокислоти і аміногрупи сусідній амінокислоти відщеплюєтьсямолекула води і за рахунок валентностей залишки амінокислот з'єднуються. Між амінокислотами виникає міцна ковалентний зв'язок звана пептидного зв'язком. Утворене з'єднання амінокислот називається пептидом. Пептид з двох амінокислот називається дипептидом, з трьох амінокислот - трипептидом, з багатьох амінокислот - полипептидом. Всі білки представляють собою поліпептиди, т. Е. Ланцюга з багатьох десятків і навіть сотень амінокислотних ланок.
Кожен живий організм містить велику кількість різних білків. При цьому кожному виду притаманні особливі, властиві тільки даному виду білки. Навіть білки, які виконують у різних видів тварин одну і ту ж функцію, відрізняються один від одного. Наприклад, у всіх хребетних тварин - риб, амфібій, птахів, ссавців - червоні клітини крові містять білок гемоглобін, що виконує у всіх тварин одну і ту ж функцію - транспорт кисню. Але гемоглобін у кожного виду тварин свій, особливий, за структурою та властивостями відрізняється від гемоглобинов інших тварин.
Для того щоб пояснити можливість існування такого величезного розмаїття білків, потрібно врахувати, що білки розрізняються за складом амінокислот, по числу амінокислотних ланок, по порядку проходження в ланцюзі. Число структурних варіантів досягає при цьому астрономічних цифр. У доповіді індійського вченого Сінга на біохімічному конгресі в Москві був приведений наступний цікавий розрахунок. Білок з молекулярною масою 34 000 містить близько 300 амінокислотних ланок (молекулярна маса одного амінокислотного ланки в середньому дорівнює 110). Нехай до складу цього білка входять не всі 20 амінокислот, а тільки 12. При таких умовах число можливих ізомерів для цього білка виявляється рівним 10 300. Для того щоб відчути громадность цієї цифри, уявімо собі 10 300 однокопієчної монет. Така купа монет важить 10 300 г (одна однокопієчної монета важить 1 г). Маса ж земної кулі 10 27 г!
Якщо врахувати, що розмір одного амінокислотного ланки дорівнює 0,35-0,37 нм, то очевидно, що макромолекула білка, яка складається з сотень амінокислотних залишків, повинна була б мати в довжину кілька десятків нанометрів. Насправді ж розміри молекул білків набагато менше. Деякі з них мають вид кульок з діаметром всього 5-7 нм. Поліпептидний ланцюг білка якось скручена, як-то покладена. Кожному білку притаманний суворо певний характер укладання. Для повної характеристики будови білкової молекули потрібне знання його первинної, вторинної та третинної структур.
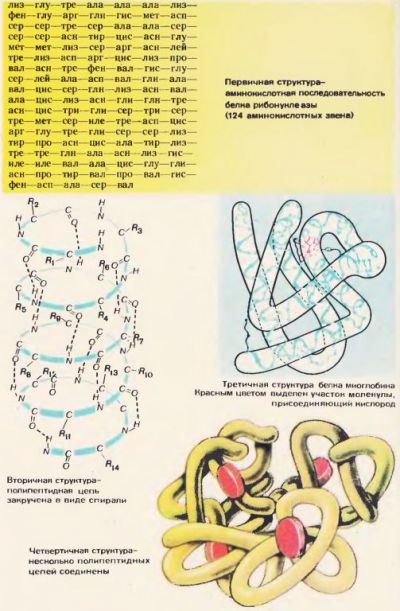
Послідовність амінокислотних залишків в молекулі білка визначає його первинну структуру. Це як би формула білка. На малюнку 72 представлена первинна структура білка рибонуклеази. До складу цього білка входять 124 амінокислотних ланки. Найчастіше поліпептидний ланцюг повністю або частково закручується в спіраль. Це вторинна структура білка. Амінокислотні радикали залишаються при цьому зовні спіралі. Витки спіралі розташовуються тісно. Між NH-групами, що знаходяться на одному витку, і СО-групами, що знаходяться на сусідньому витку, утворюються водневі зв'язку (рисунок 72). Водневі зв'язку значно слабкіше ковалентних, але, повторені багато разів, вони дають міцне зчеплення. Поліпептидна спіраль, «прошита» численними водневими зв'язками, представляє досить міцну структуру.
Поліпептидна спіраль піддається подальшій укладанні. Вона згортається химерно, але для кожного білка цілком виразно і постійно. В результаті виникає конфігурація, звана третинну структуру. Третинну структуру підтримують гідрофобні зв'язки, які виникають між радикалами гідрофобних амінокислот. Ці зв'язки слабкіше водневих. У водному середовищі в клітці гідрофобні радикали відштовхуються від води і злипаються один з одним. Таким чином, водне середовище як би примушує білкову молекулу прийняти певну впорядковану структуру, і вона стає біологічно активною.
Третинна структура не є вищою формою структурної організації білка. У живій клітині виявлено багато інших, ще більш складних її форм, наприклад четвертинні (рисунок 72).