по курсу «Мікробіологія з основами епідеміології та методами мікробіологічних досліджень»
розділ «Морфологія мікроорганізмів»
Керівництво для студентів
відділення 060110 «Лабораторна діагностика»
на керівництво до практичних занять
по курсу «Мікробіологія з основами епідеміології та методами мікробіологічних досліджень»
розділ «Морфологія мікроорганізмів»,
складене викладачем мікробіології А.В. Палієнко
Представлена робота складена відповідно Державного стандарту і кваліфікаційної характеристики спеціальності 060110 «Лабораторна діагностика». Побудовано відповідно сучасними педагогічними та методичними вимогами. Даний посібник забезпечить самостійність студентів у роботі на практичних заняттях з мікробіології і полегшить педагогічний процес. Для ефективного засвоєння матеріалу є питання і тестові завдання для студентського самоконтролю. За кожного заняття зазначений обсяг виконуваної практичної роботи. Наведені в роботі алгоритми, малюнки, схеми допоможуть систематизувати і закріпити знання студентів з даної теми.
У керівництві наводиться мікроскопічний метод дослідження мікроорганізмів, який дозволяє вивчити тинкторіальних і морфологічні властивості мікроба, ступінь чистоти виділеної культури, розташування мікроорганізмів в мазках, виявити структури клітини - спори, капсули, визначити рухливість мікроба, диференціювати кислотостійкі бактерії. Всі ці ознаки необхідні для ідентифікації мікроорганізму. За допомогою цього методу можна підтвердити клінічний діагноз інфекційних захворювань.
Навчальний посібник призначений для використання під час практичних занять з мікробіології розділ «Морфологія мікроорганізмів», а також для самостійної роботи студентів вдома.
Рецензент. Глинська Є.В. к.б.н. доцент кафедри мікробіології та фізіології рослин біологічного факультету СГУ ім. М. Г. Чернишевського
Введення в практикум ...................................................... ..6
Відповіді на тестові завдання .............................................. 31
Лабораторні заняття проводяться у спеціально обладнаних приміщеннях, що мають підведення електрики до кожного робочого місця, а також раковину з водопровідною водою. Поверхня робочих столів покрита склом для кращої дезінфекції. За кожним студентом закріплюється постійне робоче місце, на якому має бути обладнання, необхідне для виконання конкретного завдання, робочий зошит, ручка і олівець. Для особистих речей відводиться спеціальне місце.
На початку заняття студенти знайомляться з певним завданням, викладеним в навчальному посібнику, роблять записи основних методик в робочому зошиті, а потім приступають до виконання роботи під наглядом викладача. Результати досліджень у вигляді малюнків, описів морфології мікроорганізмів заносяться в зошит, і робота представляється викладачеві для перевірки.
У зв'язку з тим, що на практичних заняттях студенти працюють з живими культурами мікробів, аніліновими барвниками, хімічними речовинами, а також використовують електричні прилади (лампи) і спиртівки, вони зобов'язані виконувати основні правила техніки безпеки (додаток №1,2).
Всі завдання студентами виконуються самостійно відповідно до завдань, поставлених в навчальному посібнику.
ВСТУП В ПРАКТИКУМ
Мікроскоп (рис.1) - оптичний прилад для вивчення мікрооб'єктів. Студентські лабораторії частіше оснащені мікроскопами МБІ-1. У наукових і практичних мікробіологічних лабораторіях використовують мікроскопи вітчизняних марок: МБР - 1, МБІ-1, МБІ-2, МБІ-3, Биолам Р-1 та інші. Вони призначені для вивчення форми, структури, розмірів і інших ознак мікроорганізмів, величина яких не менше 0.2-0.3 мкм. Оскільки мікро-б дуже малі, то вимірюються вони в мікрометрів (мкм - тисячна частка міліметра) і тому вивчення їх можливо тільки за допомогою мікроскопів, що дають досить велике збільшення. Загальне збільшення мікроскопа складається з твору збільшень об'єктива і окуляра. Зазвичай при мікробіологічних дослідженнях для отримання корисного збільшення в 600-1000 разів використовують об'єктиви зі збільшенням в 90-100 разів і окуляри, що збільшують зображення в 7-10 разів.
Об'єктиви поділяються на сухі і імерсійним (занурені). При роботі з сухими об'єк-єктів між фронтальною лінзою і досліджуваним об'єктом знаходиться повітря. При цьому, на увазі раз-ниці коефіцієнтів заломлення предметного сте-кла і повітря, частина світлових променів відхиляється і залишається поза увагою.
Об'єктиви імерсійним позначають буквами О.І. і цифрами х90 і х100.
Сучасні мікроскопи мають ряд удосконалень. Так, бінокулярний мікроскоп з двома тубусами дає можливість вести спостереження однов-ременно обома очима.
Для вивчення нефарбованих об'єктів використовується фазово-контрастну пристрій. за допомогою якого можна отримати чітке контрастне зображення прозорих, що не мають забарвлення мікроорганізмів. При проходженні світла через пофарбований препарат, змінюється інтенсивність-вности світла (амплітуда світлової хвилі), що ліг-ко вловлюється оком. При проходженні ж пучка світла через незабарвлений, прозорий об'єкт изме-вується тільки швидкість його руху, тобто фаза ко-лебанія світлового променя, що оком не вловлюється. Принцип фазово-контрастного пристрою заклю-чає в перекладі невидимих коливань світла в амплітудні видимі.
У ряді спеціальних досліджень, зокрема при вивченні всередині-клітинних структур мікроорганізмів, використовується люмінесцентна мікроскопія. заснована на здатності деяких об'єктів при спеціальному фарбуванні флюорохромами світитися в короткохвильових променях світла (ультрафіолетових, синіх і ін.). До флюорохромами відносяться акридіновий жовтий, піронін, акридіновий помаранчевий. Люмінесцентна мікроскопія проводиться зі звичайним мікроскопом, сну-бженним джерелом ультрафіолетових променів і набором світлофільтрів, ви-ділячи короткохвильову частину спектру.
Найбільш досконалими приладами, які дають змогу отримувати корисне збільшення об'єкта в 200-500 тис. І більше разів, є електронні мікроскопи. в яких замість світлових променів використовується потік електронів. За допомогою електронних мікроскопів вдається розглянути білкові молекули.
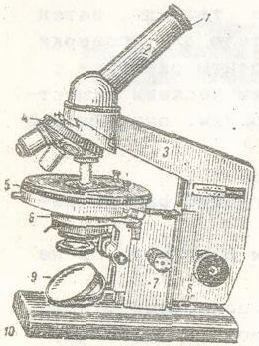
1 - окуляр, 2 - тубус,
4 - револьвер об'єктивів,
5 - предметний столик,
7 - мікрогвинт, 8 - макровінт
9 - дзеркало, 10 - підстава
Практичне заняття №1
Прості і складні методи фарбування. Забарвлення препаратів за методом Грама. Способи приготування барвників.
Студент повинен знати:
- техніку безпеки в кабінеті (лабораторії) мікробіології (додаток №1),
- вимоги до приміщення та обладнання в лабораторії (додаток №2),
- характеристика «брудної» і «чистої» зони лабораторії. Перелік кімнат і їх призначення,
- вимоги до проведення робіт в бактеріологічній лабораторії,
- спецпрофілактіка співробітникам лабораторії,
- етапи приготування препарату, його фіксація: види і мета,
- прості методи фарбування,
- складні методи, сутність методу Грама,
- особливості забарвлення за Грамом, барвники та реактиви,
- підготовка насичених, водних розчинів і барвників.
Студент повинен вміти:
- доставка патологічного матеріалу. Матеріал на патогенні біологічні агенти (БПА),
- Приймання матеріалу в реєстратурі,
- обробка відпрацьованого матеріалу і лабораторного посуду,
- поведінку при «аварії» в лабораторії,
- приготування бактеріального препарату,
- забарвлення препарату за методом Грама,
-мікроскопія забарвлених препаратів з використанням імерсійної системи,
- дотримання заходів безпечної роботи з живими культурами мікробів,
- обробка робочого місця і рук дез. речовинами.
Етапи самостійної аудиторної роботи:
1. Підготувати препарати і пофарбувати їх простим методом і методом Грама
2. Препарати промікроскопувати з иммерсией
3. Опрацювати робочі місця і руки
4. Замалювати результати микроскопирования в щоденник
Рецепти приготування барвників
1. Карболовий фуксин Ціля:
- насиченого спиртового розчину основного фуксину - 10 мл
- розчину карболової кислоти 5% - 90мл
Увага! Карболову кислоту вливають в барвник, а не навпаки. Суміш струшують, фільтрують і зливають у флакон
- основний фуксин в порошку - 1 гр
- карболова кислота кристалічна -5 гр
- спирт 96% - 10 мл
- вода дистильована - 100 мл
2. Насичені спиртові розчини (вихідні):
- спирту 96% - 10 мл
Суміш поміщають в термостат на кілька днів до повного розчинення. Збовтують щодня, зберігають з притертими пробками
3. Фуксин Пфейффера:
- фуксин Ціля - 1 мл
- води дистильованої - 9 мл
Готують безпосередньо перед вживанням, тому що розчин нестійкий.
4. Папір по Синяву:
- 1% спиртовий розчин кристалічного фіолетового:
на 100 мл 96% спирту додають 1 гр сухого барвника і 3 мл гліцерину
Смужки фільтрувального паперу просочують розчином і висушують.
ЕТАПИ ГОТУВАННЯ ПРЕПАРАТУ
1. Приготування мазка