Математичний вираз першого закону термодинаміки
Закон стверджує, що в ізольованій системі сума всіх видів енергії є величиною постійною.
Беручи це до уваги, математичний вираз першого закону термодинаміки в диференціальної формі для 1 кг робочого тіла записується в наступному вигляді:
де q - теплота, повідомляється робочому тілу, u - внутрішня енергія робочого тіла, l - робота розширення.
Оскільки в правій частині математичного виразу першого закону термодинаміки елементарна робота є неповним диференціалом, то і елементарна теплота в лівій частині теж не може бути повним диференціалом параметрів стану. Тому елементарну теплоту в термодинаміки прийнято також як і елементарну питому роботу позначати з символом # 948 ;.
Після інтегрування отримаємо такий вираз:
Тут для теплоти, також як і для роботи нижні індекси 1,2 означають, що теплота є також функцією процесу.
Перший закон термодинаміки Новомосковскется так: підведена до робочого тіла енергія у вигляді теплоти витрачається на зміну питомої внутрішньої енергії тіла і на вчинення цим тілом роботи.
Враховуючи що # 948; L = Р dv. можна записати:
# 948; q = du + P dv, [Дж / кг].
Перша форма диференціального рівняння першого закону термодинаміки для одного кг робочого тіла застосовується в закритих системах: циліндри ДВС, поршневого компресора.
Є ще кілька формулювань першого закону термодинаміки:
1. Енергіяне виникає з «нічого» і не знищується в «ніщо» .Тепловая або механічна енергія не можуть виникати з нічого або перетворюватися в ніщо.
2. Будь-яка форма руху здатна і повинна перетворюватися в будь-яку іншу форму енергіі.Оні можуть перетворюватися взаємно один в одного тільки в еквівалентних кількостях.
3. Вічний двигун першого роду неможливий (т. Е. Не можна з "нічого" виробляти роботу).
У 1755 році французька Академія наук оголосила, що більше не братиме до розгляду проекти вічних двигунів.
У теплоенергетиці величезну кількість процесів підведення теплоти здійснюється для різних робочих тіл у відкритих системах при постійному тиску (в парових котлах, камерах згоряння газових турбін і реактивних двигунів, теплообмінних апаратах), а також цілий ряд процесів в хімічних технологіях і багатьох інших. У 19-му столітті фізик Гіббс ввів функцію для теплових розрахунків, яку згодом назвали ентальпії. Ентальпія використовується частіше, ніж внутрішня енергія, з цієї причини в таблицях термодинамічних властивостей частіше наводяться значення ентальпії, а не внутрішньої енергії. Ентальпії позначається буквою I (або іноді Н) і являє собою суму внутрішньої енергії системи U і твори тиску системи р на її обсяг V:
Так як входять до неї величини є-ються функціями стану, то, також як і внутрішня енергія, ентальпія є функцією стану. Так само як внутрішня енергія, ра-бота і теплота, вона вимірюється в Джоу-лях (Дж).
Питома ентальпія позначається i (або h), т.е.можно написати
i = u + p • v. [КДж / кг] (3)
Твір р • v - це робота, яку потрібно затратити щоб ввести газ обсягом v в середу з тиском Р, тобто Р • v - це потенційна енергія газу.
Продифференцируем (3): di = du + P dv + v dP і, з огляду на, що
# 948; q = du + р • dv,
di = # 948; q + v · dP, (4)
Таким чином, питома ентальпія більше зовнішньої підведений теплоти на величину роботи v • dP.
Вираз (4) часто записують:
# 948; q = di - v · dP, (5)
Вираз (5) являє собою другу форму запису першого закону термодинаміки.
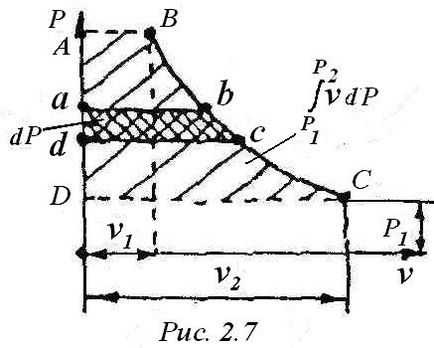
Величина роботи v • dP на графіку (рис.2.7) являє собою площу aв з dа .З (3) видно, що обидва доданків правої частини повні диференціали, отже, i- теж повний диференціал і ентальпія - функція стану. Тому після інтегрування виразу (4) маємо:
Ентальпія також відраховується від нуля, за який приймається її значення при температурі 0,01 ° С і тиск Р = 610,8 Па, а для ідеальних газів-прі Про ° С незалежно від тиску. Так як між ентальпії і внутрішньою енергією існує вищенаведена зв'язок, вибір початку відліку однієї з них не довільний: в точці, прийнятої за початок відліку внутрішньої енергії, u = 0, a i = рv. Тому, наприклад, для води при t = 0,01 ° С і р = 610,8 Па, і = 0, а i = рv = 610,8 # 8729; 0.001 = 0,611 Дж / кг.
Диференціал ентальпії дорівнює
де cр - справжня питома масова теплоємність при постійному тиску, Т - температура робочого тіла.
У практичних розрахунках, також як і для внутрішньої енергії, визначається приріст ентальпії
де середня теплоємність при постійному тиску в інтервалі температур t1 і t2.
Розмірності внутрішньої енергії та ентальпії робочого тіла такі ж, як і у теплоти і роботи - Дж або при віднесенні до одного кг робочого тіла - Дж / кг.