ЕНЕРГІЯ АКТИВАЦІЇ в елементарних р-ціях, мінім. енергія реагентів (атомів. молекул і ін. часток), достатня для того, щоб вони вступили в хім. р-цію, т. е. для подолання бар'єру на пов-сті потенційної енергії, що відокремлює реагенти від продуктів р-ції. Потенційний бар'єр - максимум потенційної енергії, через к-рий повинна пройти система в ході елементарного акту хім. перетворення. Висота потенційного бар'єра для будь-якого шляху, що проходить через перехідний стан, дорівнює потенційної енергії в перехідному стані. Якщо в складній р-ції, що складається з послідовних і паралельних елементарних р-ций, є лімітуючим елементарна р-ція (р-ція з макс. Характерним часом), то її енергія активації є і енергією активації складної р-ції. У макроскопіч. хім. кінетики енергія актіваціі- енергетичних. параметр Е а. що входить в Аррениуса рівняння: де до - константа швидкості; А - предекспоненціальний множник (постійна або слабо залежить від т-ри величина); k - константа Больцмана; Т - абс. т-ра. Графік залежності lnk від 1 / kT (Арреніус графік) - пряма лінія. Видимий енергія активації обчислюється з тангенса кута нахилу цієї прямої. У загальному випадку складних р-ций параметр Е а в ур-ванні Аррениуса є ф-цією енергії активації окремих стадій, і визначається енергія активації зв. ефективної (емпіричної, що здається).
Будь-який процес, що супроводжується до.-л. зміною енергії, є екзотермічним в одному напрямку і ендотермічним в іншому. Енергії активації екзотерміч. і ендотерміч. напрямків р-ції, що позначаються соотв. і, пов'язані співвідношенням:
де Q - .теплота р-ції при Т = 0. Якісна одномірна геом. ілюстрація зв'язку енергії активації з висотою потенційного бар'єра і теплотою р-ції представлена на рис. де q -коордіната реакції (див. також Активованого комплексу теорія); Е1 і Е2 - рівні енергії соотв. основного стану реагентів і продуктів р-ції.
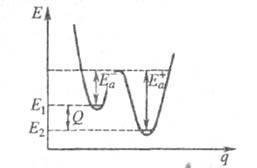
Для р-ций рекомбінації своб. радикалів (в т. ч. і атомів), а також для широкого класу екзотерміч. іонно-молекулярних реакцій енергія активації дорівнює нулю або дуже мала в порівнянні з типовими значеннями енергій хім. зв'язків Есв. Для р-ций, що супроводжуються одночасно розривом одних і утворенням інших хім. зв'язків, становить зазвичай від сотих до десятих часток Есв. якщо серед реагентів є своб. радикали, і її можна порівняти з Есв. якщо реагенти - хімічно насичені молекули. м. б. аномально великий (напр. більше енергії збудження атома Е *) в р-ціях гасіння електронного збудження при зіткненнях атомів. А * + А А + А, якщо точка перетину термів реагентів і продуктів р-ції розташована високо в порівнянні з Е * або терми не перетинаються.
Відомі емпіріч. кореляції, що встановлюють наближену зв'язок між Е а і Q для однотипних р-ций, напр. правило Поляни-Семенова:
де Е0 і - константи. Теоретич. розрахунки Е а виробляються наближеними методами квантової хімії. Точні послідовні квантовомех. обчислення виконані поки для систем, що містять не більше 3 електронів. напр. для 3 атомів водню.
Для додання системі необхідної енергії активації використовують нагрівання, дія електромагнітного випромінювання та ін. А також вводять каталізатори. напрямні хім. р-ції по шляху з меншою енергією активації.
