До теперішнього часу немає єдиної точки зору на те. які іони і в якій мірі беруть участь в перенесенні струму при електролітичному отриманні алюмінію. Більшість радянських вчених притримують теорії П. П. Федотьева, розробленої ним ще в 1923-193 2 рр. Пізніші роботи радянських вчених (В. П. Машовця, Г. А. Абрамова і ін.) Уточнили її. Відповідно до цієї теорії, розплавлений кріоліт. добре проводить струм, дисоціює на іони:
Такий характер дисоціації криолита добре підтверджується будовою його кристалічної решітки (рис. А), в ос нове якої лежить октаедр з іоном алюмінію в центрі і шістьма іонами фтору по кутах. А так як прийнято вважати, що рідина поблизу точки плавлення мало відрізняється за структурою від твердого тіла, то при плавленні криолита в ньому обов'язково повинні утворитися «осколки» його решітки, т. Е. Іони АlH 3 6 -.
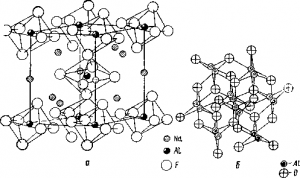
Мал. Кристалічні решітки криолита (а) і корунду (б)
Глинозем, розчинений в розплавленому кріоліті, дисоціює на іони алюмінію і кисень іони, причому П. П. Федотов вважав, що найбільш імовірною є схема
Деякі дослідники не поділяють точку зору П. П. Федотьева на характер дисоціації глинозему в електроліті. Так, В. П. Машовець припускав, що кисень знаходиться в електроліті у вигляді іонів AlO2 -. В. А. Пазухин вважав, що це - іони AlOF 4 5 -. існуючі спільно з іонами O 2. За В. М. Гуськову, А. І. Бєляєву та ін. Глинозем в кріоліту-глино-земному розплаві утворює поряд з іншими іонами іони O 2- і Аl 3+.
Мабуть, механізм процесу електролізу слід представити в наступному вигляді. Криоліт при розплавленні поблизу точки плавлення буде складатися з іонів Na + і AlF 3 6 - так як
іонні зв'язку в його кристалічній решітці між натрієм і фтором слабкіше, ніж між алюмінієм і фтором. Але це не виключає можливості подальшого руйнування кристалічної решітки на іони Аl 3+ і F -.
Оскільки кристалічна решітка глинозему складається з іонів Al 3+ і О 2 (рис. Б), то при розчиненні в розплавленому кріоліті глинозем розпадається на ці іони. Але дуже ймовірно, що іон кисню, який має малий розмір і щодо великий заряд, з'єднається з іншими іонами і утворює якісь складні кислородсодержащие іони (АlO2 - або навіть AlOF 4 5 -).
Таким чином, розплавлений електроліт алюмінієвої ванни, мабуть, складається з іонів Al 3+. Na + F - і О 2. які, перебуваючи в безперервному русі і взаємодії, можуть утворювати комплексні іони AlF 3 6 -. АlO2 -. Можливе утворення і інших комплексів. Всі ці іони беруть участь в перенесенні струму, хоча їх частка в цьому перенесення неоднакова і визначається їх концентрацією і рухливістю.
Розряджатися на електродах будуть не всі іони, які беруть участь в перенесенні струму, а лише ті, які мають відповідні величинами електроднихпотенціалів. На катоді при елект-Оліте кріоліту-глиноземних розплавів буде в першу чередь розряджатися іон Al 3+. а на аноді іон О 2.
Вирізняється на аноді кисень взаємодіє з у де родом анода і утворює суміш газів СО та СО2. Ці гази, що виділяються на поверхні анода, видаляються в атмосферу. При цьому СО згоряє до СO2. утворюючи над кіркою язики полум'я.
Таким чином, процес електролізу зводиться до отримання алюмінію і витрачання глинозему.
Анодний ефект електролізу глиноземних розплавів
1%, на нормально працюючому електролізері настає анодний ефект, зовні він виявляється таким чином: напруга на ванні (звичайно дорівнює 4,1- 4,5 В) починає підніматися на кілька десятих часток вольта, а потім стрибком зростає до 20-40 В і на контрольному вольтметри спалахує лампочка. На поверхні анода, дотичної з електролітом, виникають електричні дуги, що супроводжуються характерним шумом. Електроліт швидко розігрівається, посилюється його випаровування. Але досить розчинити в. електроліті нову порцію глинозему, як напруга на ванні знижується, анодний ефект зникає і відновлюється нормальний хід електролізу.
При електролітичному отриманні алюмінію анодний ефект відіграє велику роль. З одного боку, він полегшує обслуговування в, Анни, сигналізуючи про час завантаження в неї чергової порції глинозему, а також дозволяє судити про те, нормально або ненормально працює ванна. Якщо ванна працює нормально, анодний ефект характеризується різким стрибком напруги і виникає через однакові проміжки часу, відповідні завантажуваних в ванну порціях глинозему і робочій силі струму. Якщо анодний ефект сильно запізнюється або виникає передчасно і напруга на ванні під час анодного ефекту піднімається незначно або пульсує ( «миготлива» або «тьмяна» спалах), ванна працює ненормально і потребує особливо уважному нагляді і обслуговуванні.
З іншого боку, виникнення анодних ефектів негативно позначається на електролізі, викликаючи підвищену витрату електроенергії фтористих солей і анодів, а також ускладнює роботу джерел постійного електричного струму.
Тому на алюмінієвих заводах намагаються мати мінімальну кількість анодних ефектів, допускаючи їх виникнення не більше, ніж один раз на добу, на 2-4 хв. Передові бригади ведуть електроліз. допускаючи анодний ефект один раз в 3-5 діб.
Анодний ефект привертає увагу багатьох дослідників і на природу його є багато різних точок зору. Капітальне дослідження природи анодного ефекту було проведено в Московському інституті кольорових металів і золота ім. М. І. Калініна під керівництвом чл.кор. А. І. Бєляєва за участю Б. А. Кузьміна.
Результати досліджень дозволили зробити висновок про те, що анодний ефект властивий не тільки електролізу кріо-літо-глиноземних розплавів з вугільними анодами (як припускали багато зарубіжні дослідники), а й характерний для електролітичного процесу в розплавлених солях з будь-якими анодами. Анодний ефект виникає в тому випадку, якщо щільність струму на аноді стає вище критичної.
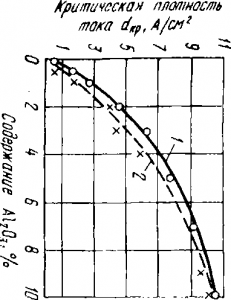
Мал. 2. Зміна критичної, щільності струму в залежності від утримуючи ня глинозему в кріоліту-глиноземних розплавах:
1 - за даними А. І. Бєляєва і Б. А. Кузьміна; 2 - за даними Карпа чева, Долгова і Кончінского
Величина критичної щільності струму, а отже, і виникнення анодного ефекту залежить від природи розплавленої солі, кількості оксидів, розчинених в розплавленої солі, матеріалу анода і температури розплавленої солі. Так, наприклад, критична щільність струму для розплавлених хлористих солей вище, ніж для фтористих солей. Особливо-сильно впливає на критичну щільність струму наявність в розплавленої солі розчинених окислів.
На рис. 2 приведена залежність критичної щільності струму в кріоліту-глиноземних розплавах від змісту Аl2 O3. Як випливає з цієї залежності, зі збільшенням вмісту Аl2 О3 в кріоліту-глиноземному розплаві підвищується критична щільність струму, а отже, зменшується ймовірність виникнення анодного ефекту. Так як алюмінієві ванни працюють при анодній густині струму від 0,7 до 1,2 А / см 2. то відповідно до графіка можна зробити висновок, що анодний ефект повинен настати при зниженні вмісту глинозему в електроліті до
Грунтуючись на результатах досліджень радянських вчених, можна уявити механізм анодного ефекту наступним чином: при значній кількості глинозему в
електроліті розплав добре змочує поверхню анода і, отже, змиває утворюються бульбашки газу. У міру зменшення концентрації розчиненого глинозему в електроліті останній починає все гірше і гірше змочувати електрод, а коли величина крайового кута змочування перевищить 90 °, перестає змочувати електрод. В результаті цього газ починає затримуватися на поверхні анода, вона швидко покривається газової плівкою, опір на кордоні анод - електроліт стрибкоподібно зростає. Лише в окремих місцях, де газова плівка тимчасово порушується, виникають короткочасні електричні дуги. При введенні в електроліт нової порції глинозему електроліт починає знову змочувати анод, швидко видаляє з його поверхні газову плівку і напруга на ванні знижується.
Побічні процеси на катоді і в електроліті
При електролітичному способі отримання алюмінію, крім розглянутих вище основних процесів, протікають деякі побічні процеси, які можуть призводити до втрати металу, підвищення витрати електроенергії, погіршення якості металу, зміни складу електроліту і т. Д .; найважливіші з них: розчинення алюмінію, освіта карбіду алюмінію, просочування футерування ванни електролітом.
Розчинення алюмінію в електроліті
Металевий алюміній розчиняється в розплавленому електроліті незначно (близько 0,1%). Однак, поширюючись по всьому об'єму електроліту, алюміній окислюється на його поверхні киснем повітря, а також реагує з анодними газами, утворюючи Аl2 O3 і викликаючи тим самим розчинення нових порцій металу в електроліті. Розчинність алюмінію в електроліті, а отже, окислення металу сильно зростає зі зменшенням межполюсного відстані і з підвищенням температури. У зв'язку з цим прагнуть вести процес при можливо низькій температурі, але не зменшуючи надмірно межполюсние відстань.
Освіта карбіду алюмінію
При перегревах ванни алюміній починає реагувати з вуглецем, що потрапляють в електроліт, утворюючи карбід алюмінію:
Сприятливі умови для утворення карбіду створюються в тому випадку, якщо з-під шару алюмінію оголюється вугільна
подина або стінка ванни (внаслідок розплавлення бічній настилу). Тоді безпосередньо на вугільній поверхні розряджаються іони алюмінію, і атоми алюмінію, взаємодіючи з вуглецем, утворюють карбід. Карбід алюмінію тугоплавок, має велику щільність і малу електропровідність; він утворюється на подине ванни під шаром алюмінію, а також в масі електроліту, створюючи додатковий опір. Алюміній може реагувати з вуглецем, проникаючи в пори і тріщини вугільної футеровки, при цьому утворюючи яскраво-жовті кристали карбіду.
Зміна складу електроліту
Що знаходиться в ванні електроліт з плином часу змінює свій склад, причому не завжди однаково. Спостереження показують, що в перші місяці роботи нової ванни її електроліт втрачає значну кількість фтористого натрію і стає кислим. У старих ваннах, що працюють більше року, спостерігається зворотна картина - електроліт втрачає фтористий алюміній і робиться лужним.
Вивчення процесів змочування фтористими солями вуглецевих матеріалів, проведене в Інституті кольорових металів і золота ім. М. І. Калініна А. І. Бєляєвим з співр. показало, що фтористий натрій змочує вуглецеві матеріали значно краще, ніж кріоліт або фтористий алюміній.
Отже, фтористий натрій. який може з'явитися в електроліті в результаті деякої дисоціації криолита, буде переважно вбиратися в пори вугільних катодів і блоків знову пущеної ванни, порушуючи тим самим кріоліту-ше ставлення електроліту. Дослідження подових блоків старих, що вийшли з ладу електролітних ванн підтверджують цей висновок. Щільність блоків за час роботи ванни зростає до моменту зупинки ванни в півтора рази, причому продукт, поглинений блоками, містить 70-75% NaF; 5 -7% AlF3; до 20% Аl2 O3. а також деяку кількість Аl4 С3 і металевого натрію.
Виборче поглинання вугільної футеровкою фтористого натрію, значне в перші місяці роботи ванни внаслідок заповнення пір, поступово зменшується і через кілька місяців повністю припиняється.
Втрати фтористого алюмінію з електроліту можливі за рахунок деякого випаровування цієї речовини. особливо під час анодних ефектів, так як пружність парів AlF3 при температурі процесу становить близько 1 кПа.
Поряд з випаровуванням фтористого алюмінію в електроліті відбувається взаємодія криолита з домішками (SiO2. Na2 O, Н2 O), що потрапляють в ванну разом з глиноземом і фтористими солями. Na2 O, що залишається в глиноземі через недостатню промивання гідрату, розкладає кріоліт за такою реакції:
SiO 2. потрапляючи в ванну як домішка глинозему і кріоліту частково розкладається, забруднюючи алюміній кремнієм, а чистячі але взаємодіє з кріоліту по реакції
утворюючи летючий четирехфторістий кремній і руйнуючи комплекси іонів фтору і алюмінію (AlF 3 6 - и ін.).
При нормальному обслуговуванні ванни в неї вводять тільки попередньо добре прогріті продукти. Тому пари води можуть потрапити в розплавлений електроліт тільки при наявності в глиноземі деякої кількості гідратів окису алюмінію. У цих випадках не виключена реакція
Всі ці реакції призводять до надлишку фтористого натрію в електроліті.