Будова саркомера і скорочення м'язи
• Міозин II являє собою мотор, який забезпечує скорочення м'язів
• Актин і міозин II є основними компонентами саркомера, основною одиницею скорочення поперечно-смугастих м'язів
М'язи представляють собою тканину, здатну до скорочення, яка забезпечує рух тіла і рухливість органів. Відповідно до зовнішнім виглядом скорочувальних волокон, м'язи можна поділити на дві основні групи: поперечносмугасті і гладкі. Волокна поперечносмугастих м'язів називаються так тому, що при великому збільшенні можна бачити їх характерну смугастість. До цієї групи належать скелетні і сердечна м'язи.
Скелетні м'язи забезпечують рухливість скелета, а серцева скорочення серця. Волокна гладких м'язів не смугастих і мають веретеноподібну форму. Ці м'язи утворюють стінки органів, наприклад сечового міхура, кровоносних судин і шлунково-кишкового тракту.
Білковий мотор, який забезпечує скорочення м'язів, відноситься до сімейства міозину II. Цей миозин належить до числа найбільш поширених білків хребетних, він легко виділяється і тому є одним з добре вивчених білків.
На малюнку нижче представлено будова молекули міозину II, що складається з шести поліпептидних ланцюгів: двох важких і двох наборів, кожен з яких складається з двох легких ланцюгів.
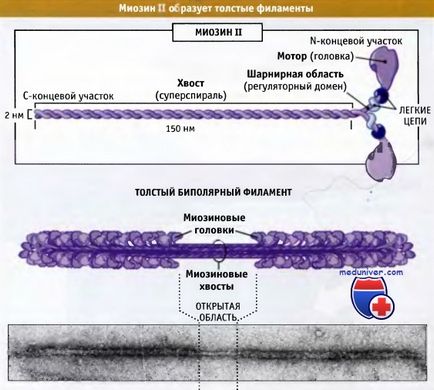
що складається з двох важких ланцюгів і двох пар різних легких ланцюгів.
Ці комплекси збираються в біполярні товсті філаменти.
Дистальний ділянка хвоста м'язового міозину II пов'язаний з іншими молекулами міозину II, утворюючи волокна, що складаються приблизно з 300 молекул міозину. Ці волокна біполярні, і моторні домени всіх миозинов спрямовані від центральної зони. Ці волокна називаються товсті біполярні філаменти. У цьому розділі ми обговоримо організацію і роль міозину II в скороченні поперечно-смугастих м'язів. Ці питання добре вивчені.
Поперечно м'язи складаються з пучків м'язових волокон. Останні являють собою великі багатоядерні клітини, довжина яких варіює від декількох міліметрів до декількох сантиметрів, а діаметр становить 20-100 мкм. Малюнок нижче показує, що кожне м'язове волокно складається більш ніж з 1000 міофібрил, які представляють собою паличкоподібні органели, здатні до скорочення. Міофібрили складаються з повторюваних одиниць, які називаються саркомеров. Саркомеров розташовані один за одним і обумовлюють характерну смугастість м'язів.
Саркомеров представляють собою основні скорочуються одиниці поперечно-смугастих м'язів; при скороченні і розслабленні м'язи їх довжина змінюється. Як показано на малюнку нижче, саркомеров містять товсті філаменти, що складаються, головним чином, з біполярних филаментов міозину II, і тонких філаментів, які містять Актинові нитки і регуляторні білки. Оперення кінці Актинові філаментів з одного боку прикріплені до структури саркомера, яка носить назву Z-диск. При цьому всі актинові філаменти з одного боку Z-диска мають однакову полярність.
Актинові філаменти прикріпляються до Z-диску і копіюються за рахунок зв'язування з копіюють білком (CapZ), що запобігає деполимеризацию актінових филаментов. Загострені кінці Актинові філаментів орієнтовані до центру саркомера і скопіюйте таким чином тропомодуліном. З Актинові філаменти також взаємодіє білок небулін; він може регулювати збірку волокон і довжину тонких філаментів.
Товсті філаменти знаходяться в центрі, на М-лінії, між Z-дисками. М-лінія являє собою структуру, що складається з гнучко пов'язаних біполярних товстих філаментів; ці зв'язки скріплюють товсті філаменти, гексагонально розташовані всередині. Поряд з М-лінією, білок филаментов, який називається титаном, утворює еластичні зв'язку між Z-дисками і міозіновимі волокнами. Тітін забезпечує центрування товстих філаментів в саркомере і діє як пружина, яка не допускає розтягуватися саркомер.
Тонкі і товсті філаменти переплітаються, утворюючи тривимірну гратчасту структуру. Оскільки саркомер біполярний, в обох половинах міозіновие мотори по відношенню до актину орієнтовані однаково. При скороченні моторні домени міозину товстих філаментів взаємодіють з актином тонких філаментів. При скороченні саркомер коротшає за рахунок ковзання тонких і товстих філаментів щодо один одного, що зближує сусідні Z-диски до центру саркомера. У міру просування головок міозину до зазубреним кінців актінових филаментов, довжина товстих і тонких філаментів залишається тих, хто поститься.
Ширина саркомера в розслабленому м'язі хребетних становить близько 3 мкм, а при скороченні вона стає близько 2,4 мкм.
У м'язовому волокні коротшають групи. що складаються з тисяч саркомерів, що призводить до укорочення всього м'яза. Загальна довжина укороченого м'язового волокна визначається двома факторами: довжиною, на яку коротшає кожен саркомер, і кількістю саркомерів в групі. Процентна величина, на яку відбувається укорочення м'язових волокон, одна і та ж, незалежно від їх довжини.
Величина зусилля, що генерується саркомером. пропорційно числу акто-миозинових взаємодій в половині саркомера, а величина зусилля, яке розвиває мишчное волокно, пропорційно числу паралельно розташованих саркомеров. Таким чином, штангісти збільшують свою силу за рахунок збільшення площі поперечного перерізу м'язів, а не за рахунок їх довжини.
Як показано на малюнку нижче, скорочення поперечно-смугастих м'язів регулюється за участю тропонин-тропоміозинового комплексу, який пов'язаний з актином в тонких філаментах. Молекули тропомиозина є суперспіралізованние поліпептиди довжиною 40 нм. Вона розташовуються один за одним уздовж Актинові спіралей. Тропонин уявляєте собою комплекс з трьох різних білків: тропонина С, тропоніну I і тропоніну Т. Один комплекс зв'язується з тропоміозіном так, що вони розташовуються уздовж тонких філаментів через 40 нм інтервали.
При низьких концентраціях іонів кальцію тропомиозин знаходиться в такому стані, що просторово блокує сайт зв'язування міозину на актине, так що м'яз розслабляється і гідроліз АТФ під дією міозину відбувається дуже повільно. За рахунок взаємодії актину з міозином релаксовані саркомеров здатні до пасивного розтягування, надаючи невеликий опір.
Нервові імпульси викликають вихід кальцію в цитозоль з саркоплазматичного ретикулума. Останній являє собою органеллу, яка депонує кальцій в м'язі. Підвищення рівня кальцію в цитозолі призводить до його зв'язування з тропонином-С і до конформаційних змін в молекулі білка. В результаті цих змін тропомиозин відходить від міозин-зв'язуючого сайту в актине, і міозин отримує можливість взаємодіяти з актином і генерніровать зусилля за рахунок механохімічного циклу.
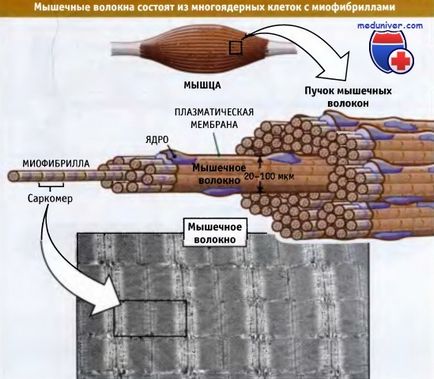
Міофібрили здатні до скорочення і містять повторювані структурні одиниці, звані саркомерами.
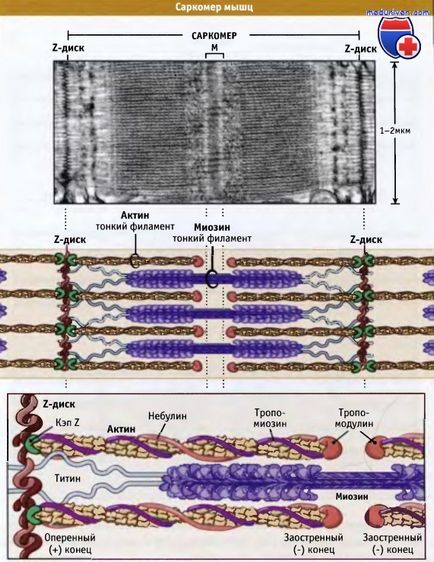
Товсті міозіновие філаменти з'єднуються з Z-диском через білок тітін і вплітаються між актиновими філментамі.
Небулін проходить від Z-диска до тропомодуліну. Однак як він пов'язує актин, поки невідомо.
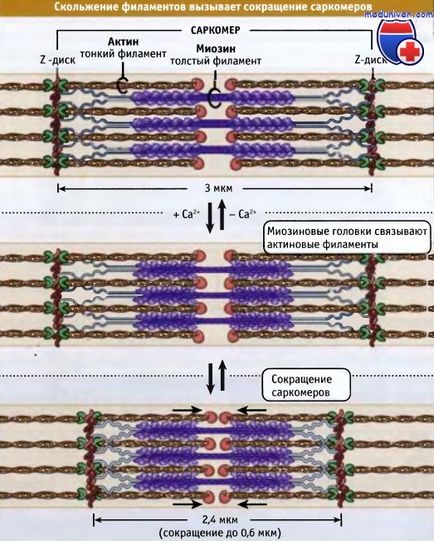
що Z-диски зсуваються відносно один одного. При цьому довжина саркомера зменшується.
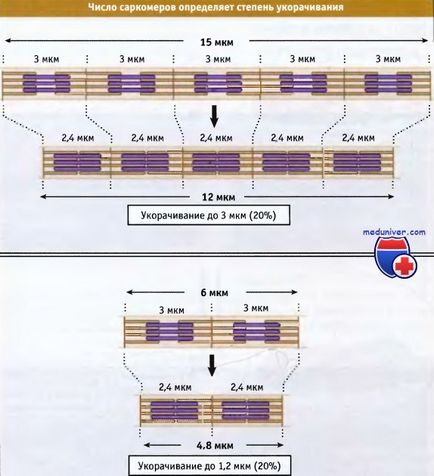
Однак в процентному відношенні величина укорочення не залежить від числа саркомерів.
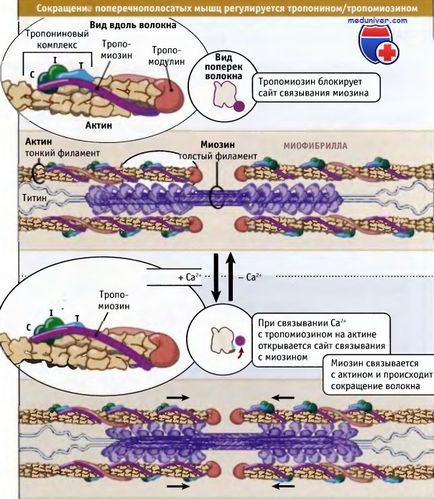
який визначає положення комплексу тропонин / тропомиозин щодо міозину і актину.