Здатність до руху - одне з характерних властивостей усіх живих організмів, починаючи від найпростіших і закінчуючи найскладнішими. Скорочення різних м'язів і рух листя рослин, биття війок і рух джгутиків, поділ клітин і рух протоплазми - всі ці різноманітні форми прояву рухової активності мають спільну рису -перетворення хімічної енергії, що звільняється при гідролізі АТФ, в механічну. Тобто м'язи - це «машини», що перетворюють хімічну енергію безпосередньо в механічні енергію (роботу) і теплоту. Регулятором рухової активності в м'язах є кальцій. З'ясування молекулярних механізмів генерації сили, трансформації хімічної енергії гідролізу АТФ в механічну роботу, а також механізмів регуляції цих процесів є основним завданням біофізики біологічного рухливості. Найбільші успіхи в цьому напрямку досягнуто при дослідженні найбільш організованих поперечно-смугастих м'язів хребетних.
Перш ніж перейти до розгляду сучасних уявлень про механізм скорочення м'язи, слід зупинитися на структурної організації її основних скорочувальних елементів -міофібрілл і саркомерів.
Будова м'язового волокна.
Скелетні м'язи складаються з багатоядерних клітин, пов'язаних збудливою плазматичноїмембраною, по якій приходить нервовий імпульс, який ініціює скорочення м'язи. Діаметр миоцита значно поступається його довжині. Переважання довжини над товщиною в такий веретенообразной клітці дозволяє називати її волокном (рисунок 1). Разом з тим слід зазначити, що м'язове волокно утворюється шляхом злиття безлічі окремих клітин. Тому в міоцену (вельми великої клітці) міститься кілька ядер.
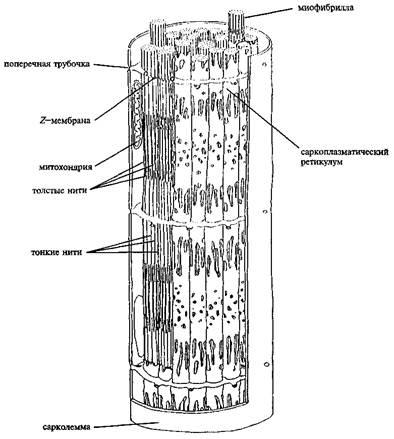
Усередині миоцита (в поздовжньому його перетині) знаходиться близько 10 3 міофібрил. М'язові клітини складаються з безлічі скорочувальних волокон - міофібрил, розташованих паралельно один одному (рисунок 1). Міфібрілли - здатні до скорочення, пучки ниток діаметром близько 1 мкм. Перегородки, звані Z-дисками, поділяють міофібрили в поперечному напрямку на окремі компартменти довжиною по 2,5 мкм, які називаються саркомерами
Саркомер є елементарною надмолекулярной скорочувальної одиницею м'язового волокна. На електронно-мікроскопічних знімках поздовжнього зрізу м'язової тканини видно, що саркомер складається з паралельних рядів товстих і тонких ниток (рисунок 2, а). Вертикальні темні лінії Z відповідають спеціальним структурним білкам (десмін), що розділяє міофібрили на саркомеров. Між ними видно горизонтальні нитки скорочувального апарату. Від Z-ліній відходять тонкі нитки, яким на електронно-мікроскопічних знімках відповідають світлі смуги I. У центральній частині саркомера розташовані товсті нитки, яким відповідають темні смуги А. В середині кожної смуги А видна більш світла смуга Н. Наявність двох темних ділянок смуги А визначається тим, що в цих зонах товсті нитки перетинаються тонкими нитками. Більш світла смуга (зона Н) відповідає ділянці саркомера, де товсті нитки не перетинаються з тонкими нитками. Анізотропні диски (А) мають подвійне променезаломлення (див. Попередні теми): в звичайному світлі виглядають темними, а в поляризованому - прозорими (світлими) в поздовжньому, і непрозорими (темними) в поперечному напрямках. Ізотропним дискам (I) не властиво подвійне променезаломлення.
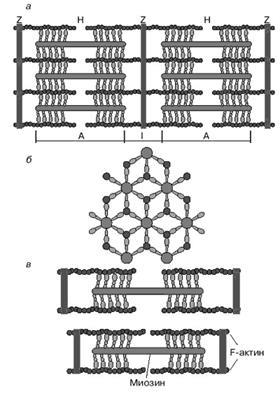
Малюнок 2. Схематичне зображення будови саркомерів м'язового волокна: а - поздовжній розріз, б - поперечний розріз в області перетину товстих і тонких ниток, в - зміна довжини саркомера в результаті руху товстих і тонких ниток
Товсті нитки складаються головним чином з молекул міозину. Тонкі нитки містять білки трьох типів: актин, тропомиозин і тропонин. Якщо подивитися на поперечний зріз саркомера в області, де є сусідами товсті і тонкі нитки (темний ділянку смуги А), то можна побачити, що кожна тонка нитка оточена трьома товстими нитками, а кожна товста нитка оточена шістьма тонкими нитками (рис. 2 б). Взаємодія між тонкими і товстими филаментами здійснюється за допомогою так званих поперечних містків, утворених головками миозинових молекул (малюнки 2, 3а, 3в). Вони розташовані по відношенню до поздовжньої осі міозіновой нитки під кутом 120 °. Поперечний місток працює як хіміомеханіческій перетворювач (тобто перетворювати енергію АТФ в механічні гребкові руху). При скороченні м'яза (при русі її Актинові і міозінових ниток відносно один одного) саркомер може зменшити свою довжину на одну третину (рисунок 2, в).
Для того щоб товсті нитки міозину почали гребкові руху (при скороченні) своїми поперечними містками (рисунок 3, а), головка міозину повинна вступити у взаємодію з активним центром на актиновой нитки. У розслабленому м'язі він прикритий ( «зачохлив») молекулою тропомиозина (рисунок 3, б). Молекула тропомиозина скручена навколо двох ниток актину по спіралі і перекриває активні центри, з якими повинні вступити у взаємодію міозіновие головки, щоб відбулося скорочення м'язи.
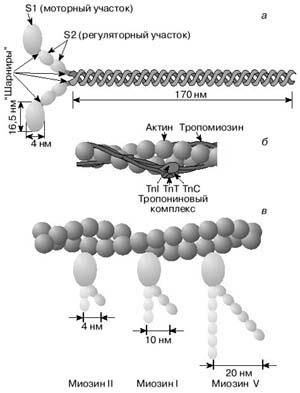
Малюнок 3. Будова молекули міозину (а) і тонкої нитки (б). У розслабленому м'язі тропомиозин перешкоджає взаємодії головки міозину з актином (б). Внизу (в) схематично показано відмінність геометричних характеристик моторних ділянок молекул міозину трьох різних типів
Крім актину, міозину і тропомиозина, міоцити поперечносмугастих м'язів містять важливий регуляторний білок тропонин, який пов'язаний з Актинові філаментів і з тропоміозинового ниткою (рисунок 3, б). Одна з субодиниць, що утворюють тропоніновим комплекс здатна зв'язуватися з іонами Са 2+. Коли така взаємодія відбувається, тропонин впливає на тропомиозин і той звільняє на актиновом филаменте активний центр для міозину. Тим самим усувається перешкода їх взаємодії (рисунок 3, в). Далі відбувається безпосередньо акт м'язового скорочення.