ЗАГАЛЬНІ УЯВЛЕННЯ ПРО фолдінг
Процес утворення білків складається з трьох стадій:
і завершується доставкою білка до місця його майбутнього функціонування. Для цього існують спеціальні механізми, і рішення проблеми починається ще з трансляції.
Трансляція - послідовне включення амінокислот в споруджувані пептидні ланцюга відповідно до послідовність кодонів мРНК
У процесі трансляції беруть участь 4 види рРНК, які в полісом об'єднуються з рибосомальні білками, формуючи субодиниці рибосом. Ці субодиниці через ядерні пори переміщаються в цитоплазму. Туди ж переміщаються і багато мРНК в комплексі зі спеціальними білками і кілька десятків видів тРНК. З іншого боку в цитоплазмі присутні 20 видів амінокислот. синтезованих в самій клітині або надійшли з крові. Також тут знаходиться 20 видів ферментів - аміноацил-тРНК -сінтетаза і додаткові білкові фактори. Всі ці речовини беруть участь в:
· Фолдінг - згортання пептидного ланцюга в просторову структуру
· Модифікації - приєднання вуглеводних компонентів, окислення певних амінокислотних залишків і т.д.
За місцем остаточної локалізації в клітині білки поділяють на: експортні, мембранні, лізосомальні і внутрішні.
Експортні - тобто призначені до виділення з клітини, мембранні і лізосомальні білки утворюються мембранозв'язані рибосомами. Тобто рибосомами, прикріпленими до поверхні мембран ендоплазматичної мережі (ЕРС). Завдяки цьому край синтезованого пептиду проникає у внутрішній простір ЕРС де потім виявляється і весь білок. У цьому ж просторі відбувається фолдінг і модифікація білка. Далі в транспорті і модифікації беруть участь інші мембранні структури, перш за все апарат Гольджі і, в кінцевому рахунку, білок
- або виділяється в ході екзоцитозу з клітини,
- або включається до складу тієї чи іншої мембрани,
- або залишається всередині сформувалася лізосоми.
На відміну від цього внутрішні білки (білки гіалоплазми, мітохондрій, ядра і т.д.) синтезуються на вільних, тобто мембранонесвязанних рибосомах.
Розрізняють декілька рівнів структури білків: первинну, вторинну, третинну, а для олігомерних білків - і четвертинних структури.
Первинна структура - це послідовність амінокислотних залишків, пов'язаних один з одним пептидними зв'язками. Саме дана структура безпосередньо кодується послідовністю кодонів в мРНК і відтворюється при трансляції.
Принципово важливо, що практично всі 20 амінокислотних залишків, що зустрічаються в природних білках, мають подібний план будови. Вони містять тричлен остов, із середнім (a-вуглецевим) атомом якого пов'язаний той чи інший радикал (R). З'єднуючись один з одним пептидними зв'язками, вони формують безперервний остов пептидного ланцюга. де чергуються три типи зв'язку (рис.1.1).
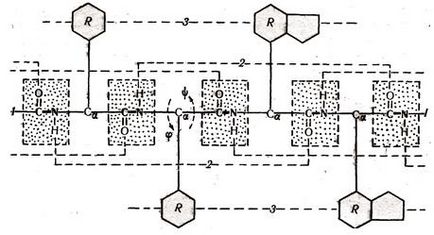
Мал. 1.1 Первинна структура білків
Навколо однієї з них - пептидного зв'язку СО-NH- обертання неможливі. Навколо двох інших -NH-Ca Н і -Ca Н-СО - можливо обертання. Це дозволяє пептидного ланцюга згинатися, утворюючи вторинну і третинну структури.
Вторинна структура. Спочатку багато фрагментів пептидного ланцюга набувають періодичну укладку того чи іншого типу: a-спіраль або b-структура. Такий тип укладання називається вторинною структурою. В одній і тій же молекулі глобулярного білка можуть зустрічатися різні види вторинної структури і також безструктурні ділянки. Співвідношення між ними по-різному (табл.1.1).
У фібрилярних білках вторинна структура як правило одноманітна. Альфа спіраллю представлені білки - міозин, тропомиозин, альфа-кератин. У цих білках кілька ланцюгів з альфа-спіраллю закручені в суперспіраль. Білки тільки з бета-структурою - фібрин шовку і бета-кератин (утворюється з a-кератину при обробці гарячою парою).
Таблиця 1.1. Розподіл амінокислотних залишків між трьома
варіантами вторинної структури
Особливий вид вторинної структури в білку коллагене, який має спільні риси і з альфа- і з бета- структурами і називається колагенової спіраллю.
В a-спіралі остов пептидного ланцюга закручується в спіраль так, що радикали амінокислот звернені назовні від спіралі (рис.1.2).
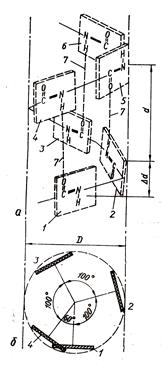
Мал. 1.2. Вторинна структура білків. Альфа-спіраль
Структура утримується водневими зв'язками між кістяками амінокислот, причому в освіті такого зв'язку бере участь -NH-група однієї амінокислоти і -CO- - інший, яка в пептидного ланцюга відділена від першої 3-ма іншими амінокислотами. У підсумку на один виток a-спіралі доводиться в середньому 3,6 амінокислотних залишків. Альфа-спіраль утворюється тільки тому, що є найбільш термодинамічно вигідним станом для даної ділянки пептидного ланцюга.
b-структура - остови пептидних кіл виконувати не скручені в спіраль, а мають зигзагоподібну конфігурацію (структура складчастого листа, рис.1.3). Утримується водневими зв'язками між тими ж групами, але тепер (якщо мова йде про глобулярні білки) для зближення цих груп і утворення зв'язків
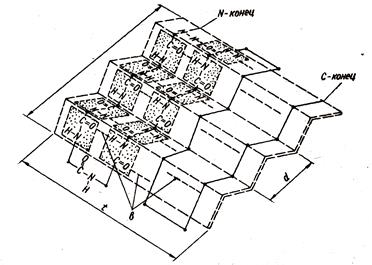
Мал. 1.3. Вторинна структура білків. Бета-структура
пептидная ланцюг утворює складки 2-х видів - великі складки в результаті повороту ланцюга на 180 0 і дрібні вигини ланцюга в межах однієї складки. Прилеглі один до одного ділянки ланцюга в b-структурі можуть бути як паралельними так і антипаралельними (рис.1.4 і 1.5).
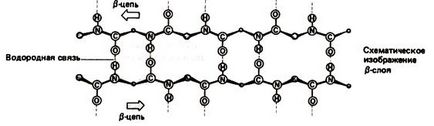
Мал. 1.4. Антипаралельні долі ланцюга в b-структурі
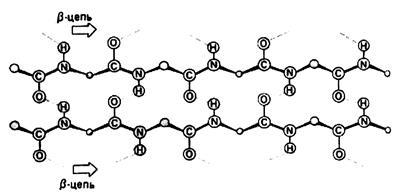
Рис.1. 5. Паралельні ділянки ланцюга в b-структурі
У фібрилярних білках з b-спіраллю в утворенні водневих зв'язків беруть участь сусідні і розташовані паралельно пептидні ланцюга.
Вторинна структура білка або його фрагмента визначається його первинною структурою.
Бічні радикали амінокислот хоча і не беруть участі в стабілізуючих цю структуру зв'язках, але визначають, яким чином пептидная ланцюг може згорнутися для освіти таких зв'язків і чи може згорнутися взагалі. Наприклад, залишки проліну і гідроксипроліну повністю виключають утворення в своєму локусе як a-спіралі так і b-структури. Однойменно заряджені радикали амінокислот через взаємного відштовхування не можуть зблизитися в a-спіралі і т.д.
Третинна структура. Про третинної структурі зазвичай говорять стосовно лише до глобулярним білків. Під нею розуміють конформацию білкової глобули, тобто укладка в просторі a-спіральних, b-структурних і безструктурні ділянок пептидного ланцюга. На відміну від вторинної, третинна структура утворюється і утримується за рахунок утворення зв'язків безпосередньо між радикалами амінокислот. Характер зв'язків залежить від природи радикалів (табл.1.2).
Таблиця 1.2 Типи радикалів амінокислот і утворені ними зв'язку
У тому числі: 28 гідрофобних і 65 гідрофільних
Як видно з даних табл. 1.3, основна частина гідрофобних-радикалів знаходиться всередині глобули (куди вони йдуть від водної фази), а більшість гідрофільних радикалів - на її поверхні. У той же час це правило не є абсолют-ним: кілька гідрофобних радикалів залишається на поверхні.
Останнє дуже важливо для взаємодії білка з лігандами, що мають гідрофобні групи.
Формування третинної структури грає ре-шує роль в придбанні білком властивою йому функцио-нальної активності. Як правило, саме на рівні цієї структури в білку з'являються т.зв. активні центри (один або кілька) - групи з декількох радикалів, здатні спе-ціфічно взаємодіяти з певними лигандами.
Ці радикали на рівні первинної структури часто знаходяться далеко один від одного і зближуються лише в процесі фолдинга.
Разом з тим третинна структура володіє певною рухливістю. На конформації глобули можуть позначатися такі чинники:
- теплові флуктуації і коливання окремих груп, коли зв'язки між ними то розриваються, то знову заступники-каються;
- хімічна модифікація білка (наприклад, фосфорилювання);
- саме виконання білком його функції.
Зміна конформації білків - найважливіший спосіб через трансформаційних змін їх біологічної активності, який широко ис-користується в клітці для регуляції різних процесів.
Четвертичная структура. Поняття четвертичной структури може бути застосовано тільки до білків, що складається з декількох субодиниць. (Напр. Гемоглобін складається з 4 субодиниць 2-х видів). Четвертинної структурою володіє близько 5% білків, в тому числі гемоглобін, імуноглобулін, інсулін. Майже всі ДНК і РНК-полімерази мають четвертинних структуру. Зв'язки, що утворюють і підтримують четвертинних структуру, ті ж самі, що і при утворенні третинної структури, крім гідрофобних.
Субодиниці зв'язуються за рахунок взаємодії амінокислотних радикалів розташованих на контактуючих поверхнях субодиниць. Ці поверхні по розташуванню радикалів є взаємно комплементарними. Зокрема, вони нерідко збагачені гідрофобними і разноименно зарядженими радикалами. Таким чином, зв'язування субодиниць може відбуватися лише після утворення третинної структури. І таке зв'язування саме позначається на третинної структурі доводячи її до функціонально активного або неактивного білка. Тому такі білки зазвичай активні лише в олігомерної формі (гемоглобін) або навпаки тільки в дисоційованому стані (протеїнкінази). В цьому випадку одні субодиниці служить для придушення активності інших і диссоциируют під впливом спеціального сигналу (цАМФ).