При біологічному окисленні від органічної молекули під дією відповідного ферменту отщепляются два атома водню. У ряді випадків при цьому між ферментами і окисленої молекулою утворюється нестійка, багата енергією (макроенергетичних) зв'язок. Вона використовується для освіти АТФ - "кінцевої мети" більшості процесів біологічного окислення. А два відібраних атома водню виявляються в результаті реакції пов'язаними з коферментом НАД (никотинамидадениндинуклеотида) або з НАДФ (нікотінамідаденін-дінуклеотідфосфатом).
Подальша доля водню може бути різною. При анаеробному окисленні він переноситься на деякі органічні молекули. При аеробного окислення водень передається на кисень з утворенням води. Основна частина ланцюга перенесення водню розташована в мембранах мітохондрій. При цьому з АДФ і неорганічного фосфату утворюється АТФ.
Треба відзначити, що аеробне окислення набагато ефективніше анаеробного. У першому випадку з 1 молекули глюкози утворюється 2 молекули АТФ, а в другому - 36, де глюкоза "спалюється" до CO2 і води. Це і пояснює широке поширення і бурхливу еволюцію аеробних організмів.
Основне джерело енергії в клітині - окислення субстратів киснем повітря. Цей процес здійснюється трьома шляхами: приєднанням кисню до атому вуглецю, отщеплением водню або втратою електрона. У клітинах окислення протікає в формі послідовного перенесення водню і електронів від субстрату до кисню. Кисень відіграє в цьому випадку роль відновлюється з'єднання (окислювача). Окислювальні реакції протікають з вивільненням енергії. Для біологічних реакцій характерні порівняно невеликі зміни енергії. Це досягається за рахунок дроблення процесу окислення на ряд проміжних стадій, що дозволяє запасати її невеликими порціями у вигляді макроергічних сполук (АТФ). Відновлення атома кисню при взаємодії з парою протонів і електронів призводить до утворення молекули води.
Тканинне дихання. Це процес споживання клітинами тканин організму кисню, який бере участь в біологічному окисленні. Такий вид окислення називають аеробним окисленням. Якщо кінцевим акцептором в ланцюзі перенесення водню виступає не кисень, а інші речовини (наприклад піровиноградна кислота), то такий тип окислення називають анаеробним.
Т.ч. біологічне окислення - це дегидрирование субстрату за допомогою проміжних переносників водню і його кінцевого акцептора.
Дихальна ланцюг (ферменти тканинного дихання) - це переносники протонів і електронів від окисляемого субстрату на кисень. Окислювач - це з'єднання, здатне приймати електрони. Така здатність кількісно характеризується окислювально-відновним потенціалом по відношенню до стандартного водневого електроду, рН якого дорівнює 7,0. Чим менше потенціал з'єднання, тим сильніше його відновлюють властивості і навпаки.
Т. о. будь-яке з'єднання може віддавати електрони тільки з'єднанню з більш високим окислювально-відновним потенціалом. У дихального ланцюга кожна наступна ланка має більш високий потенціал, ніж попереднє.
Дихальна ланцюг складається з:
1 НАД - залежною дегідрогенази;
2 ФАД- залежною дегідрогенази;
3 убіхінон (КоQ);
4 Цітохрмов b, c, a + a3.
НАД-залежні дегідрогенази. Як коферменту містять НАД і НАДФ. Піридинове кільце нікотинаміду здатне приєднувати електрони і протони водню.
ФАД і ФМН-залежні дегідрогенази містять в якості коферменту фосфорний ефір вітаміну В2 (ФАД).
Убіхінон (КоQ) забирає водень у флавопротеїдів і перетворюється при цьому в гідрохінон.
Цитохроми - білки хромопротеїди, здатні приєднувати електрони, завдяки наявності в своєму складі в якості простетичної груп железопорфіріна. Вони приймають електрон від речовини, що є трохи більш сильним відновником, і передають його більш сильному окислювача. Атом заліза пов'язаний з атомом азоту імідазольного кільця аміноксилот гистидина з одного боку від площини порфіринового циклу, а з іншого боку з атомом сірки метіоніну. Тому потенційна здатність атома заліза в цитохромах до зв'язування кисню подавлена.
У цитохроме з порфириновая площину ковалентно пов'язана з білком через два залишку цистеїну, а в цитохромах b і а. вона ковалентно НЕ связанос білком.
У цитохроме а + а3 (цитохромоксидази) замість протопорфірину містяться порфирин А, який відрізняться поруч структурних особливостей. П'яте координаційне положення заліза зайнято аминогруппой, що належить залишку аміноцукри, що входить до складу самого білка.
На відміну від гема гемолгобіна атом заліза в цитохромах може зупинити переходити з двох в тривалентне стан, це забезпечує транспорт електронів.
Механізм роботи електронтранспортной ланцюга. Зовнішня мембрана мітохондрій проникна для більшості дрібних молекул і іонів, внутрішня майже для всіх іонів (крім протонів Н) і для більшості незаряджених молекул.
Процеси окислення і утворення АТФ з АДФ і фосфорної кислоти, тобто фосфорилювання протікають в мітохондріях на внутрішній мембрані - кристах. Така молекула містить в собі три макроергічних зв'язку. Макроергічним або багатою енергією називають хімічний зв'язок, при розриві якої вивільняється більше 4 ккал / моль. При гидролитическом розщепленні АТФ до АДФ і фосфорної кислоти вивільняється 7,3 ккал / моль. Рівно стільки ж витрачається для утворення АТФ з АДФ і залишку фосфорної кислоти і це один з основних шляхів запасання енергії в організмі.
У процесі транспорту електронів по дихальному ланцюгу вивільняється енергія, яка витрачається на приєднання залишку фосфорної кислоти до АДФ з утворенням однієї молекули АТФ і однієї молекули води. В процесі перенесення однієї пари електронів по дихальному ланцюгу вивільняється і запасається у вигляді трьох молекул АТФ 21,3 ккал / моль. Це становить близько 40% вивільнилися при електронному транспорті енергії.
Такий спосіб запасання енергії в клітині називається окислювальним фосфорилюванням або зв'язаних фосфорилюванням.
Швидкість окисного фосфорилювання залежить в першу чергу від змісту АТФ, чим швидше вона витрачається, тим більше накопичується АДФ, тим більша потреба в енергії і отже активніше йде процес окисного фосфорилювання. Регуляцію швидкості окисного фосфорилювання концентрацією в клітці АДФ називають дихальним контролем.
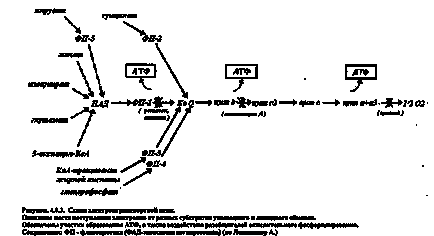
Малюнок 27-Дихальний контроль