Сполучна тканина в цілому становить приблизно 50% від маси всього тіла. Сполучна тканина - це тканина підшкірної клітковини, сухожиль, зв'язок, хрящів, а також органічний матрикс кісток і зубів, міжм'язові фасциальні прошарку. Сполучна тканина оточує кровоносні судини, пов'язує між собою клітини окремих тканин, заповнюючи простір між клітинами так званим основним речовиною (внутріорганная строма паренхіматозних органів, нейроглия мозку і т. Д.).
Сполучна тканина складається з трьох головних елементів (див. Схему).
1. Клітини сполучної тканини (фібробласти, хондроцити). У порівнянні з іншими тканинами їх мало. Тому проміжну речовину займає більше місця, ніж клітинні елементи.
2. Колагенові, еластичні і ретикулярні волокна, розташовані в оточенні проміжної речовини.
3. Проміжна речовина (основна речовина), що оточує клітини і волокна сполучної тканини.
Існує три головних молекулярних компонента сполучної тканини: два фібрилярних білка - колаген та еластин, які в різних співвідношеннях присутні в більшості видів сполучної тканини, і протеоглікани - молекули, що представляють собою білки, ковалентно пов'язані з полісахаридами.
Колаген - це основний білок колагенових волокон. Колагенові волокна - це морфологічні утворення, що містять крім білка колагену і інші хімічні компоненти.
Колаген має специфічний амінокислотний склад: приблизно 1/3 (33%) амінокислотних залишків доводиться на гліцин. Кількість пролина в коллагене також значно вище, ніж в інших білках. Нарешті, в коллагене є дві амінокислоти, які вкрай рідко зустрічаються в інших білках, а саме гидроксипролин і гідроксилізин:
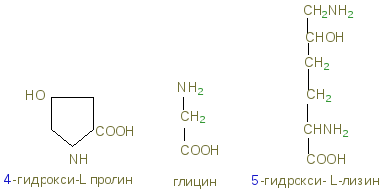
пролин і гидроксипролин становлять ¼ частина всіх амінокислотних залишків і близько 1% - гідроксилізин. У коллагене певна послідовність амінокислот: майже кожен 3-й залишок - це гліцин; часто повторюється ділянку гліцин-пролін-гидроксипролин.
Основною структурною одиницею колагену є тропоколагену, молекулярна маса якого становить близько 285000 Д. тропоколагену складається з трьох поліпептидних ланцюгів однакового розміру. Кожна поліпептидний ланцюг тропоколагену містить близько 1000 амінокислотних залишків, тобто основна структурна одиниця колагену - тропоколагену має великі розміри, зокрема, вона в більш ніж в 10 разів більше химотрипсина.
Молекула тропоколагену має форму стрижня. Кожна з трьох його поліпептидних ланцюгів має форму левозакрученной α-спіралі. Крім того, ці три спіраль ланцюга закручуються відносно один одного, утворюючи тугу правозакрученной нитку. Три поліпептидні ланцюга пов'язані між собою водневими зв'язками, що виникають, в основному, за рахунок водню пептіднихNH-групи гліцину і киснем пептидних С = О-груп амінокислотних залишків на інших ланцюгах.
Колаген синтезується клітинами з вільних амінокислот. Однак, гидроксипролин і гідроксилізин не включаються до складу поліпептидного ланцюга колагену в процесі біосинтезу колагену. Ці амінокислоти утворюються за участю ферментів відповідно пролінгідроксілази і лізінгідроксілази, а також за участю аскорбінової кислоти після включення проліну і лізину в поліпептидний ланцюг. Зазначені ферменти містять в активному центрі атом заліза в фероформе (відновлене стан атома железеFе2 +). Аскорбінова кислота виконує роль відновного агента, зберігаючи атом заліза в фероформе. Залишки гидроксипролина надають структурі додаткову стабільність за рахунок утворення великої кількості внутрішньо молекулярних водневих зв'язків (для цього використовуються навколишні молекули води). За відсутності аскорбінової кислоти колаген виявляється негідроксілірованним і тому не може утворити нормальні по структурі колагенові волокна, що призводить до ураження шкіри і ламкість судин, настільки чітко виражених при цинзі.
Тропоколагену, як це представлено на схемі, синтезується фібробластами у вигляді проколагену.
Поліпептидні ланцюги проколагену мають додаткові пептидні ділянки на кінцях поліпептидних ланцюгів (рис. Перетворення проколагену в тропоколагену). Ці пептидні ділянки називаютсяN-кінцеві і С-кінцеві пептиди.
Схема формування зрілого генового волокна