3. Застосування електролітів
Електроліти грають важливу роль в науці і техніці. Вони беруть участь в електрохімічних та багатьох біологічних процесах, є середовищем для органічного та неорганічного синтезу та електрохімічного виробництва.
Пристрої з твердими оксидними електролітами. Головне призначення твердих оксидних електролітів бачилося в створенні паливних елементів - хімічних джерел струму, в яких енергія газу безпосередньо перетворюється в електричну. Паливні елементи - близькі родичі гальванічних елементів. Але ті служать, поки в їх електроліті і електродах є активні речовини, а паливні елементи можуть працювати як завгодно довго, поки до них підводиться пальне. Систематичні дослідження твердих оксидних електролітів почалися в Німеччині на початку 50-х років, а з кінця 50-х розгорнулися в СРСР, США і Канаді. У нашій країні ці роботи з самого початку вів Інститут хімії Уральського філії АН СРСР (Свердловськ, нині Єкатеринбург), і школа високотемпературної електрохімії твердих електролітів, створена на Уралі, стала унікальною за широтою охоплення проблеми і глибині її вивчення.
Конструкцій, в основі яких лежать тверді оксидні електроліти, запатентовано дуже багато, але принцип їх дії однаковий і досить простий. Це пробірка з парою електродів на стінці, зовні і всередині. Вона поміщена в нагрівач; всередину пробірки і в простір, її оточує, можна підводити газ. Подивимося, які функції можуть виконувати такі пристрої.
Потенціометричні датчики складу газу. Напевно, вони найбільш прості. Електроди в різних газах набувають різні потенціали. Якщо, скажімо, всередині пробірки знаходиться чистий кисень, а зовні - газ з невідомої його концентрацією, то по різниці потенціалів електродів можна цю концентрацію визначити.
Потенціометричні датчики дозволяють визначати склад і більш складних газових сумішей, що містять вуглекислий і чадний гази, водень і водяну пару. Якщо стержень з твердого електроліту з електродами на торцях нагрітий нерівномірно, він почне втрачати кисень і між електродами виникне різниця потенціалів. За її величиною можна визначити, наприклад, склад вихлопних газів автомобільного двигуна. На Заході, де вимоги до чистоти вихлопних газів дуже суворі, такі датчики випускаються мільйонами. У нас же на такі "дрібниці" поки не звертають уваги.
Кисневі датчики поки єдині пристрої з твердими оксидними електролітами, що знайшли практичне застосування.
Кисневі насоси. Нехай у зовнішній простір пробірки подається повітря або газ, що містить кисень. Якщо зовнішній електрод став анодом, а внутрішній - катодом, то з газу в пробірку піде чистий кисень. Подібні пристрої - кисневі насоси - можуть знайти застосування там, де споживання кисню невелика або потрібна його висока чистота.
Електролізери. Тепер до зовнішнього електрода - катода - підводять водяна пара або вуглекислий газ. На катоді буде відбуватися розкладання пара або вуглекислого газу, а на аноді в обох випадках виділяється кисень. Унікальна здатність цього високотемпературного електролізера одночасно розкладати водяна пара і вуглекислий газ дозволяє створити систему життєзабезпечення, скажімо, на космічних об'єктах.
Теплоелектрогенератор. Людина зробила перший крок до незалежності від природи, навчившись зберігати вогонь, воістину універсальне джерело енергії. Багаття давав тепло і світло, на ньому готували їжу, він витрачав рівно стільки палива, скільки було необхідно. Багаття тисячоліттями залишався головною енергетичною установкою людини, і не дивно, що ми відчуваємо якусь ностальгію по вогнищу з палаючими дровами.
Ще в кінці минулого століття світ давали свічки і гасові лампи, а тепло - печі. Лише трохи більше ста років тому на людину почало працювати електрику, яке могло давати світло, тепло, механічну роботу. Якийсь час здавалося, що досить підвести до оселі тільки електричну енергію, а вже там перетворювати її в що завгодно. Але сказала своє слово економіка: ккд електростанції менше 40%, втрати при передачі та зворотному перетворенні електрики в інші види енергії теж значні. Ясно, що там, де потрібно тільки тепло, його доцільно отримувати прямо з палива. І не випадково сьогодні обговорюється проста ідея: повернути "вогнище" в будинок у вигляді електрохімічного генератора з паливним елементом, що перетворює енергію палива в електрику і тепло.
Паливні елементи. Нехай до зовнішніх стінок пробірки подається водень, а всередину її - кисень. Між електродами виникне напруга біля вольта, за що сполучає їх ланцюга потече струм, і на електродах підуть реакції, зворотні тим, що проходять в електролізері. Зовнішній електрод стане анодом, внутрішній - катодом, а пристрій перетвориться в джерело струму - твердооксидних паливний елемент.
Одне і те ж пристрій може служити і паливним елементом, і електролізером, дозволяючи акумулювати електричну енергію. В період низького її споживання незатребувана потужність електростанцій використовується для отримання водню. В піку споживання електролізер починає працювати як паливний елемент, виробляючи електрику з водню перетворити вугілля, нафта, різні гази і спирти (які, наприклад, в Бразилії використовують як пальне для автомобілів). Елемент послужить основою електрохімічного генератора, здатного істотно змінити концепцію постачання житла енергією. Найбільш простий в технічному відношенні генератор на природному газі - метані або пропані.
Як показують дослідження, його електричний ккд досягає 70%. Решта 30% енергії палива виділяються у вигляді тепла, яке можна використовувати в парових турбінах. Ккд такої комбінованої установки може перевищити 80% - такої високої ефективності немає ні у одного генератора.
Вісім років тому в Інституті високотемпературної електрохімії Уральського відділення РАН був виготовлений демонстраційний генератор на метані потужністю один кіловат. Але до практичної реалізації справа ніяк не дійде. Дослідно-конструкторські роботи, які вже починалися, до кінця так і не доведені. Завдання дуже складна, її необхідно вирішувати в рамках національної програми, спроби розробити яку виявилися поки безуспішними.
Електроліт лужної натрієво-літієвий широко застосовується в автомобільній і гірничо-видобувної промисловості. Головне призначення цього електроліту - заповнення різних лужних акумуляторів. Його використовують для наповнення акумуляторів електричних навантажувачів і спеціальних шахтних електровозів.
Електроліт кислотний застосовується для заливки в свинцеві акумулятори легкового та вантажного автотранспорту.
Для приготування електроліту в ванну, футерованную свинцем, наливають плавиковий кислоту HF і в неї додають борну кислоту Н3 ВО3. Отриману борфтористоводородной кислоту HBF4 фільтрують і, розчиняють в ній вуглекислий кадмій. Для отримання блискучого покриття застосовують електроліт наступного складу, г / л. Покриття виробляють при катодного щільності струму 9-10 А / дм2 і температурі 50 ° С.
При Кадміювання деталей складної геометричної форми застосовують Амміакатние електроліти, що розсіює здатність яких вище, ніж кислих. Найчастіше застосовується електроліт наступного складу, г / л.
Покриття проводять при катодного щільності струму 0,5 - 1,0 А / дм 2, рН = 6,9 і температурі ванни 20-25 ° С. Цей електроліт має гарну буферною ємністю і не вимагає частих коригувань.
З введенням декстрину поліпшується структура поверхні і підвищується катодна поляризація. Введення флюоресцина сприяє отриманню мелкокристаллической структури.
Ціанисті електроліти дозволяють отримувати покриття дуже високої якості, проте в силу високої токсичності компонентів і необхідності застосовувати дорогі і складні очисні споруди для очищення зворотних вод ці електроліти на світлотехнічних заводах не застосовують.
Інші електроліти, такі, як фенолсульфатние і етилендіамінового, не отримали широкого застосування, так як робота з ними малопродуктивна.
Пасивування кадмієвих покриттів проводять значно рідше, ніж цинкові.
При пассивированием деталі занурюють на 5-10 с в розчин, після чого їх виймають і ретельно промивають у проточній воді, сушать деталі в потоці теплого повітря.
Отже, підіб'ємо підсумки: Електролітами називають речовини, розчини та сплави яких з іншими речовинами електролітично проводять гальванічний струм.
Ознакою електролітичної провідності на відміну від металевої має вважати можливість спостерігати хімічне розкладання даної речовини при більш-менш тривалому проходженні струму. У хімічно чистому стані електроліти зазвичай мають мізерно малою електропровідністю.
Термін електроліт введений в науку Фарадеем. К.Е. До електролітів до самого останнього часу відносили типові солі, кислоти і луги, а також воду. Дослідження наведених розчинів, а також дослідження при дуже високих температурах значно розширили цю область.
І.А. Каблуків, Каді, Карара, П. І. Вальдо і ін. Показали, що не тільки водні та спиртові розчини помітно проводять струм, але також розчини в цілому ряді інших речовин, як наприклад, в рідкому аміаку, рідкому сірчистого ангідриду і т. П .
Знайдено також, що багато речовин і суміші їх, чудові ізолятори при звичайній температурі як наприклад, безводні окисли металів (окис кальцію, магнію та ін.), При підвищенні температури стають електролітичними провідниками.
Відома лампа розжарювання Нернста, принцип якої був відкритий геніальним Яблочкова, представляє чудову ілюстрацію цих фактів. Суміш оксидів - "тільце для розжарювання" в лампі Нернста, що не проводить при звичайній температурі при 700 ° робиться чудовим і притому зберігає твердий стан електролітичним провідником.
І наостанок вважаю за потрібне сказати про визначення електролітів, даному маститим Гитторф п'ятдесят років тому: "Електроліти - це солі". Цим визначенням Гитторф частиною передбачив сучасну теорію електролітичноїдисоціації, вказавши на те, що типове властивість солей, яке ми тепер визначаємо, як здатність до електролітичноїдисоціації, має бути ознакою будь-якого електроліту.
Список використаної літератури
1. Глінка Н.Л. Завдання і вправи з загальної хімії. Навчальний посібник для вузів. / Под ред. В.А. Рабиновича і Х. М. Рубіної. - 21-е изд. стереотипне - Л. Хімія, 1981.
2. Глінка Н.Л. Загальна хімія: Навчальний посібник для вузів. - 22-е видання. испр. / Под ред. Рабиновича В.А. - Л. Хімія, 1982.
3. Глінка Н.Л. Загальна хімія: Підручник для нехімічних вузів. - М. Хімія, 1988.
5. Лаврієнко В.Н. В.П. Ратніков, В.Ф. Голуб та ін. Концепції сучасного природознавства: Підручник для вузів. / Под ред. проф. В.Н. Лаврієнко, проф. В.П. Ратникова. - М. Культура і спорт, ЮНИТИ, 1977.
6. Ландсберг Г.С. Елементарний підручник фізики: Навчальний посібник. У 3-х т. / Под ред. Г.С. Ландсберга. Т. II. Електрика і магнетизм. - 10-е изд. перераб. - М. Наука. Головна редакція фізико-математичної літератури, 1985.
7. Електрохімія розплавлених сольових і твердих електролітів. Термодинаміка сольових і окисних систем. Свердловськ. 1969р.
Інформація про роботу «Електроліти і їх властивості»
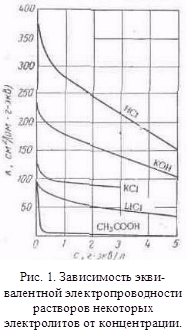
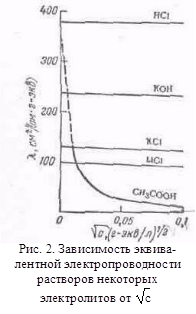
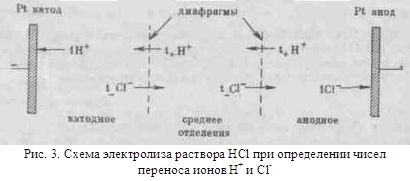
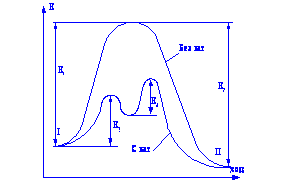
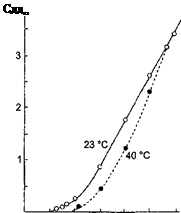
з іншими розчинниками рассмот-ренние закономірності зберігаються, але є і відступу від них, наприклад на кривих # 955; -з часто спостерігається мінімум (аномальна електропровідність). 2. Рухливість іонів Зв'яжемо електропровідність електроліту зі швидкістю руху-ня його іонів в електричному полі. Для обчислення Електроприв-водності досить підрахувати число іонів.
з киснем, відновленням - відібрання кисню. З введенням в хімію електронних уявлень поняття окисно-відновних реакцій було поширене на реакції, в яких кисень не бере. У неорганічної хімії окислювально-відновні реакції (ОВР) формально можуть розглядатися як переміщення електронів від атома одного реагенту (відновника) до атому іншого (.
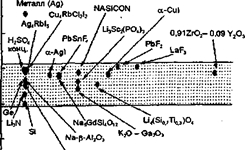
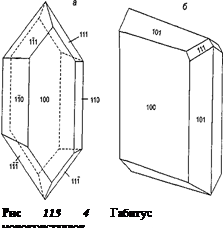
при вивченні синтезу нових матеріалів і процесів іонного транспорту в них. У чистому вигляді такі закономірності найбільш чітко простежуються при дослідженні монокристалічних твердих електролітів. У той же час при використанні твердих електролітів в якості робочих середовищ функціональних елементів необхідно враховувати, що потрібні матеріали заданого виду і форми, наприклад у вигляді щільної кераміки.
17-25 кг / т алюмінію-ня, що на
10-15 кг / т вище в порівнянні з результатами для пес-чаного глинозему. У глиноземі, використовуваному для виробництва алюмінію, має міститися мінімальна кількість сполук заліза, кремнію, важких металів з меншим потенціалом виділення на катоді, ніж алюміній, тому що вони легко відновлюються і перехо-дять в катодний алюміній. Небажано також присутність в.