Для розбавлених розчинів закон Рауля формулюється так: тиск насиченої пари розчинника над розчином (P1) пропорційно мольної частці розчинника в розчині (N1):
де Р10 - тиск насиченої пари над чистим розчинником.
У скоєних розчинах кожен компонент підпорядковується закону Рауля, який в цьому випадку записується в такий спосіб:
де
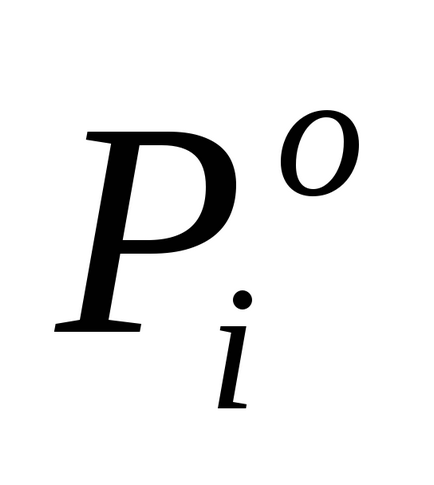
В цьому випадку загальний тиск насиченої пари над розчином дорівнює сумі парціальних тисків насиченої пари компонентів розчину:
Рівняння Рауля, що враховує дисоціацію розчиненої речовини в розведених розчинах, має вигляд:
де i - ізотонічний коефіцієнт Вант-Гоффа, що показує, у скільки разів збільшується число часток в розчині за рахунок дисоціації, і пов'язаний зі ступенем дисоціації α наступним співвідношенням:
де ν- число часток, на які дисоціює молекула в розчині.
Залежно підвищення температури кипіння (ΔТкіп. = Т - Токіп.) І зниження температури замерзання (ΔТзам. = Тозам.- Т) розбавлених розчинів від концентрації розчинів виражаються наступними рівняннями для недіссоціірующіх речовин
і рівняннями для диссоциирующих речовин
Де Токіп. Тозам. - температури кипіння і замерзання чистого розчинника;
m- моляльність розчину;
Кеб. і ККР. - ебуліоскопічна і кріоскопічна константи розчинника, що залежать від його природи і не залежать від природи розчинених речовин. Значення цих констант наводяться в довідковій літературі.
Щодо підвищення температури кипіння (ебуліоськопічеський метод дослідження - Ебуліоськопія) або по зниженню температури замерзання (кріоскопічний метод дослідження -кріоскопія) розбавлених розчинів можна розраховувати концентрації растворовm. ізотонічний коеффіціентi. ступінь дисоціації розчиненого веществаα і, з огляду на, що моляльність визначається співвідношенням (2.5), його молярна массуM2:
П р и м і р 2.2. Тиск насиченої пари води над розчином нелетучего речовини в воді нижче на 2% тиску пара над чистою водою. Визначити моляльність цього розчину. Молярна маса води М1 = 18 г / моль.
Рішення
Знайдемо молярну частку розчиненої речовини в цьому розчині, для чого скористаємося рівнянням закону Рауля (2.7):
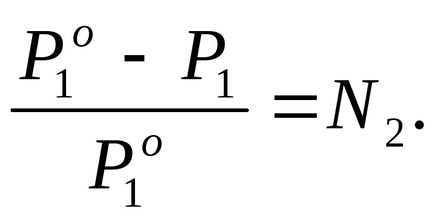
За умовою завдання P1 на 2% нижче
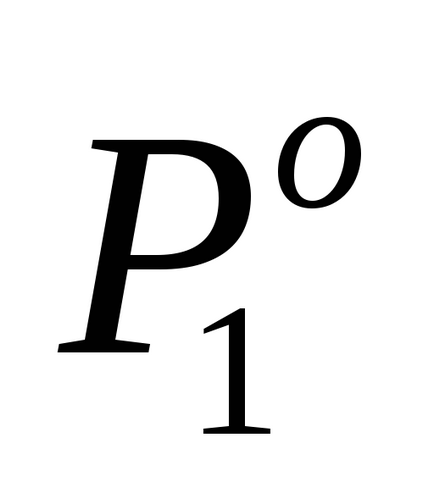
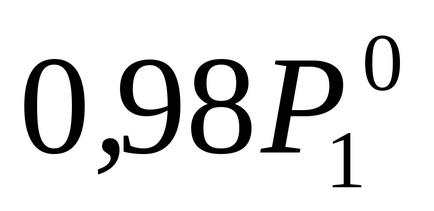
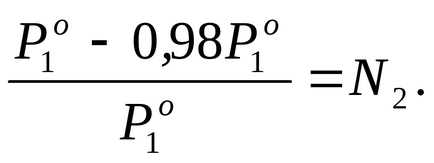
Для визначення молекулярний m розрахуємо кількість молів розчиненої веществаn2. припадає в розчині на 1000 г води. У цьому случаеm = n2.
Кількість молей води в 1000 г складає:
Відповідно до визначення (2.2) запишемо вираз для молярної частки розчиненої речовини:
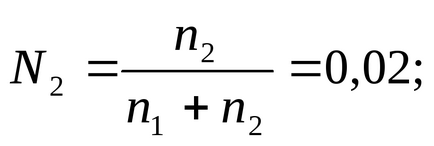
в яке підставимо значення n1. а замість n2-m. і знайдемо цю величину:
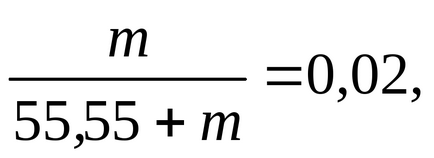
m = 1,134 моль / 1000 г води.
П р и м і р 2.3. Розрахувати загальний тиск насиченої пари над бінарним досконалим розчином при температурі 313 К, що складається з 200 г дихлоретану C2H4Cl2 (ДХЕ) і 350 г бензолаC6H6 (Б). якщо тиску насиченої пари над цими чистими речовинами при вказаній температурі складають: РоДХЕ = 2,066 × 10 4 Па і
Знаходимо кількості молей компонентів в розчині:
сумарна кількість молей речовин:
Розрахуємо молярні частки кожного компонента в розчині:
Тиск насиченої пари над розчином кожного компонента знаходиться за рівнянням закону Рауля для досконалих розчинів (2.7):
Загальний тиск розраховуємо за рівнянням (2.8):
П р и м і р 2.4. Розрахувати температуру замерзання (кристалізації) 1% розчину сірки S в залозі Fe. якщо температура кристалізації чистого заліза становить 1813 К, а його ККР. = 101,5 К / моль. Молярна маса сірки 32 г / моль.
Якщо даний розчин містить 1% розчиненої речовини, то в 100 г цього розчину міститься 1 г сірки g2 і 99 г заліза g1. Розрахуємо моляльність розчину сірки в залозі за рівнянням (2.5):
Зниження температури замерзання розраховуємо за рівнянням (2.12):
Температура замерзання розчину сірки в залозі:
П р и м і р 2.5. Розрахувати, яка кількість етиленгліколю C2H4 (OH) 2 необхідно додати до 500 г води g1. щоб знизити температуру замерзання розчину на 3 градуси. Кріоскопічна константа води ККР. = 1,86 град / моль. Молярна маса етиленгліколю М2 = 62 г / моль.
Знаходимо моляльність розчину за рівнянням (2.15):
З формули (2.5) для розрахунку молекулярний:
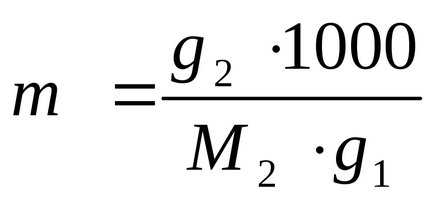
висловлюємо і розраховуємо величину g2:
П р и м і р 2.6. Обчислити молярну масу речовини, якщо температура замерзання розчину, що містить 200 г бензолу g1 і 0,4 г досліджуваної речовини g2. на 0,17 До нижче температури замерзання бензолу. Кріоскопічна константа бензолу ККР. = 5, 16 К / моль.
Розрахунок проводимо за формулою (2.18) для кріоскопії:
П р и м і р 2.7. Обчислити гадану ступінь дисоціації солі BaCl2 в 3,2% -ному водному розчині, якщо температура кипіння водного розчину дорівнює 100,21 про С. Молярна маса хлориду барію 208 г / моль. Ебуліоскопічна константа води Кеб. = 0,512 град / моль.
Визначимо моляльність розчину за формулою:
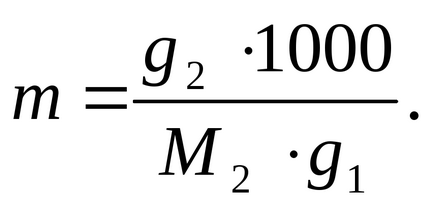
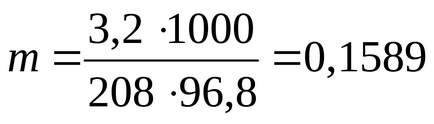
де 100 о С - температура кипіння чистого розчинника (води).
Знаходимо ізотонічний коефіцієнт з рівняння (2.17):
.
Ступінь дисоціації α знаходимо зі співвідношення (2.10):
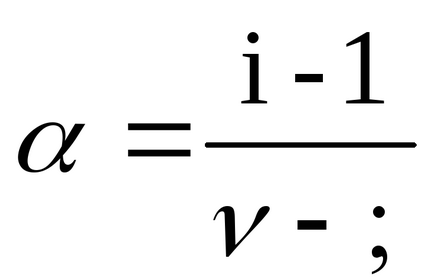
для BaCl2ν = 3, так як при дисоціації однієї молекули цієї солі утворюються три іона;
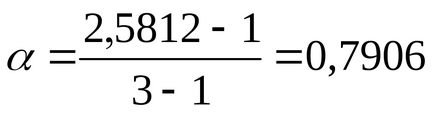
Знайдена ступінь дисоціації для сильного електроліту є здавалося б, а справжня близька до 1 відповідно до теорії Арреніуса.