С (графіт) + О2 (г) = СО2 (г) # 916; Н.
Уявімо у вигляді схеми:
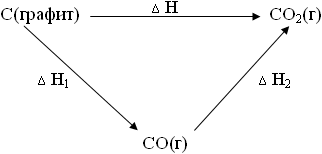
Це означає, що якщо всі три процесу задовольняють вимогу Тісх. = Тконечн. і Рісх. = Рконечн .. то не залежно від того, згорає графіт відразу в СО2 або спочатку в СО, а потім СО в СО2. тепловий ефект буде одним і тим же.
Наслідки із закону Гесса:
- Якщо в результаті послідовних хімічних реакцій система приходить в стан, повністю збігається з вихідним (круговий процес), то сума теплових ефектів цих реакцій буде дорівнює нулю.
- Тепловий ефект реакцій (# 916; Нх.р.) Дорівнює сумі теплот освіти (або # 916; Нобре. ) Кінцевих речовин (# 916; Нконеч. В-в) за вирахуванням суми теплот утворення вихідних речовин (# 916; нісх. В-в):
Ізобарно-ізотермічний потенціал (енергія Гіббса)
З розглянутого раніше випливає, що в хімічних процесах одночасно діють дві тенденції:
1. Прагнення частинок об'єднатися в більш складні, що зменшує ентальпію.
2. Прагнення частинок роз'єднатися, збільшити безлад, що збільшує ентропію.
Сумарний ефект цих двох протилежних тенденцій в процесах, що протікають при постійній температурі і постійному тиску, відображає зміну ізобарно-ізотермічного (або для стислості - ізобарного) потенціалу # 916; G:
# 916; G = # 916; Н - T # 916; S,
де # 916; Н - зміна ептальпіі (теплосодержания системи), кДж / моль;
# 916; S - зміна ентропії (міри безладдя систем), Дж / моль • К;
T - температура, К.
Ізобарний потенціал вимірюється в ккал / моль або кДж / моль.
характер змін # 916; G дозволяє судити про принципову можливість або неможливість протікання процесу:
якщо # 916; G <0, т. е. изобарный потенциал в ходе реакции уменьшается, то процесс возможен и, начавшись, он протекает самопроизвольно (спонтанно).
якщо # 916; G> 0, то неможливо здійснити процес в даних умовах.
якщо # 916; G = 0, спостерігається стан хімічної рівноваги.
Не весь відповідь. На частину немає!
Швидкість хімічної реакції можна виразити як зміна кількості речовини (n, по модулю) в одиницю часу (t) - порівняйте швидкість рухомого тіла у фізиці як зміна координат в одиницю часу: # 965; = # 916; x / # 916; t. Щоб швидкість не залежала від обсягу судини, в якому протікає реакція, ділимо вираз на обсяг реагуючих речовин (v), тобто отримуємо зміну кількості речовини в одиницю часу в одиниці об'єму, або зміна концентрації однієї з речовин в одиницю часу:
де c = n / v - концентрація речовини,
Умови, що впливають на швидкість хімічних реакцій
1) Швидкість реакції залежить від природи реагуючих речовин. Простіше кажучи, різні речовини реагують з різною швидкістю. Наприклад, цинк бурхливо реагує з соляною кислотою, а залізо досить повільно.
2) Швидкість реакції тим більше, чим вище концентрація речовин. З сильно розведеною кислотою цинк буде реагувати значно довше.
3) Швидкість реакції значно підвищується з підвищенням температури. Наприклад, для горіння палива необхідно його підпалити, тобто підвищити температуру. Для багатьох реакцій підвищення температури на 10 ° C супроводжується збільшенням швидкості в 2-4 рази.
4) Швидкість гетерогенних реакцій збільшується зі збільшенням поверхні реагуючих речовин. Тверді речовини для цього зазвичай подрібнюють. Наприклад, щоб порошки заліза і сірки при нагріванні вступили в реакцію, залізо має бути у вигляді дрібних тирси.
Зверніть увагу, що в даному випадку мається на увазі формула (1)! Формула (2) виражає швидкість на одиниці площі, отже не може залежати від площі.
5) Швидкість реакції залежить від наявності каталізаторів або інгібіторів.
Каталізатори - речовини, що прискорюють хімічні реакції, але самі при цьому не витрачаються. Приклад - бурхливий розкладання перекису водню при додаванні каталізатора - оксиду марганцю (IV):
Оксид марганцю (IV) залишається на дні, його можна використовувати повторно.
Інгібітори - речовини, що уповільнюють реакцію. Наприклад, для продовження терміну служби труб і батарей в систему водяного опалення додають інгібітори корозії. В автомобілях інгібітори корозії додаються в гальмівну, охолоджуючу рідину.
Активність каталізатора різко зменшується в присутності речовин, званих каталітичними отрутами. Якщо каталізатор і реагуючі речовини знаходяться в одному агрегатному стані, зазвичай газоподібному або рідкому, то каталіз називається гомогенним. У ролі каталізаторів в гомогенному каталізі часто виступають розчини кислот, основ, солей d-елементів, розчинники. Каталіз є гетерогенним. якщо каталізатор і реагуючі речовини знаходяться в різних агрегатних станах або утворюють самостійні фази. У ролі каталізаторів в цьому випадку найчастіше виступають тверді речовини, зазвичай d-елементи або їх сполуки. Каталізатори не змінюють ентальпію і енергію Гіббса реакції і не впливають на стан хімічної рівноваги реакції. Каталізатори тільки збільшують в рівній мірі швидкість прямої і зворотної реакцій.
Розрізняють гомогенні і гетерогенні системи. Гомогенної називається система, що складається з однієї фази, гетерогенної - система, що складається з декількох фаз. Фазою називається частина системи, відокремлена від інших її частин поверхнею розділу, при переході через яку властивості змінюються стрибком.
Хімічна рівновага в гомогенних системах
У разі рівного розподілу ентальпійного і ентропійного факторів # 916; Н = Т # 916; S # 916; G = 0, що є термодинамічним умовою хімічної рівноваги. Хімічна рівновага має динамічний характер. Швидкість реакції (число частинок утворюються в одиницю часу в одиниці об'єму) в прямому напрямку дорівнює швидкості реакції в зворотному напрямку. У цей момент концентрації вихідних речовин і продуктів реакції не змінюються в часі і називаються рівноважними концентраціями. Вони позначаються символом речовини в квадратних дужках.