Вирішивши систему рівнянь, знайдемо невідомі n1 і n2:
Висловлюючи що входять до формули величини в одиницях СІ, підставивши їх значення, виконавши обчислення, отримаємо
1.2. Внутрішня енергія і теплоємності ідеального газу
Внутренняяенергіягаза складається з енергії окремих молекул. В одному кіломоле будь-якого газу міститься NА молекул (NА --чісло Авогадро). Отже, один кіломоль ідеального газу має внутрішню енергію, рівну
Внутрішня енергія довільної маси газу m:
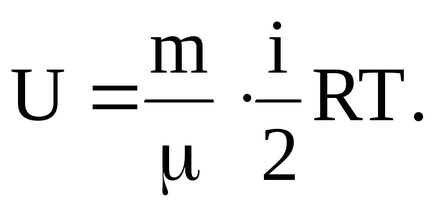
де - молярна маса газу.
Питомою теплоємністю "c" газу називається фізична величина, чисельно равнаяколічеству теплоти, яку необхідно повідомити одиниці маси газу для нагрівання її на один градус.
Молярної теплоємністю "C" називається фізична величина, чисельно рівна кількості теплоти, яку необхідно повідомити одному молю газу, щоб збільшити його температуру на один градус.
Зв'язок між питомою і молярної теплоємності:
Питома теплоємність при постійному об'ємі "Cv" - фізична величина, що чисельно дорівнює кількості теплоти, яку необхідно повідомити одному молю газу, щоб збільшити його температуру на один градус в умовах постійного обсягу.
Питома теплоємність при постійному тиску "Cp" - фізична величина, що чисельно дорівнює кількості теплоти, яку необхідно повідомити одному молю газу, щоб збільшити його температуру на один градус в умовах постійного тиску.
Якщо газ нагрівається при постійному об'ємі, то підводиться до газу тепло ідётна збільшення його внутрішньої енергії. Отже, в цьому випадку зміна внутрішньої енергії газу при нагріванні його на один градус дорівнюватиме молярнойтеплоёмкості
При нагріванні одного молягаза в условіяхпостоянного тиску повідомляє йому ззовні тепло йде не тільки на збільшення його внутрішньої енергії, а й на здійснення роботи проти зовнішніх сил.
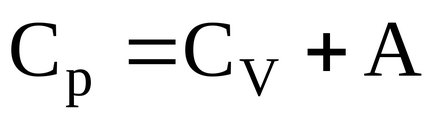
Робота, що здійснюється по розширенню одного благаючи газу, в умовах постійного тиску
де R - універсальна газова стала.
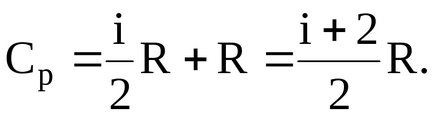
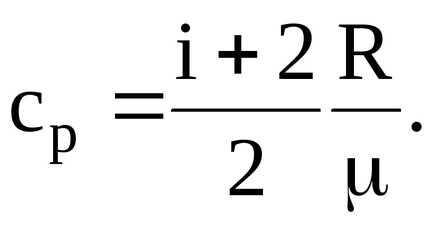
1.2. Приклади розв'язання задач
1.2.1. Обчислити питомі теплоємності при постійному тиску і при постійному обсязі неону і водню, приймаючи гази за ідеальні.
Рішення. Між молярними і питомими теплоємності ідеального газу при постійному тиску і при постійному обсязі існує зв'язок:
Таким чином, для удельнихтеплоемкостей маємо:
Знаючи, що неон одноатомнийгаз дляніх число ступенів свободи i = 3, = 2010 -3 кг / моль, а водень двоатомний газ для нього число ступенів свободи i = 5, = 2710 -3 кг / моль. Підставляючи в кожну з вище записаних формул значення і значення універсальної газової постійної R = 8,31 Дж / (мольК), обчислюємо питомі теплоємності для:
.
1.2.2. Знайти відношення питомих теплоємностей при постійному тиску і постійному обсязі для кисню.
Рішення. Ставлення питомі теплоємності при постійному тиску і постійному обсязі ідеального газу дорівнює відношенню його молярних теплоємність при постійному тиску і постійному обсязі:
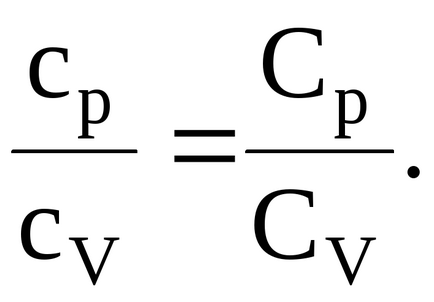
Знаючи, що молярні теплоємності при постійному тиску і при постійному обсязі пов'язані з числом ступенів свободи та є рівними
Для відносини питомі теплоємності матимемо
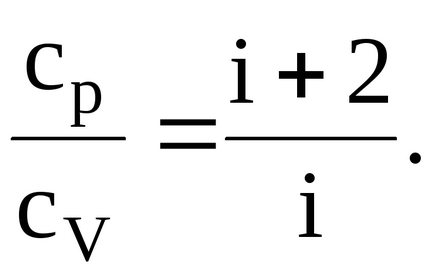
Кисень двоатомний газ, отже, число ступенів свободи i = 5. Підставляючи значення i в вишезапісанную формулу, маємо:
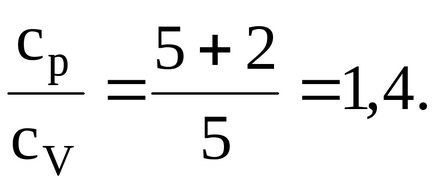
1.2.3. Питома теплоємність деякого двоатомних газу дорівнює 14,7 кДж / (кгК). Знайти молярну масу цього газу.
Рішення. Відомо, що питома теплоємність при постійному тиску пов'язана з молярної теплоємністю газу:
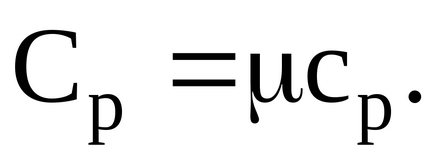
Молярна теплоємність при постійному тиску
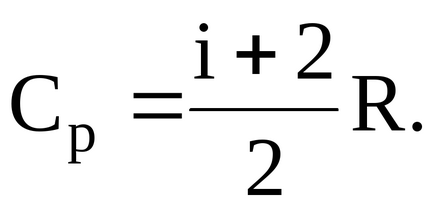
де I - число ступенів свободи газу.
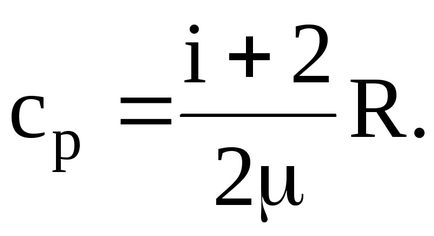
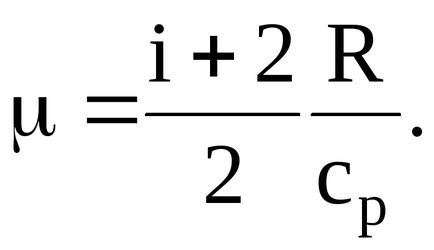
Подставляяв отриману формулу значення даних в умові завдання величин, сучетом того, що для двоатомних газу i = 5, матимемо:
1.2.4. Обчислити питомі теплоємності при постійному обсязі і постійному тиску суміші неону і водню, якщо масові частки неону і водню складають 1 = 80% і 2 = 20% відповідно. Питомі теплоємності для неону СV = 6,2410 2 Дж / (кгК), сp == 1,0410 3 Дж / (кгК); для водню-СV = 1,0410 4 Дж / (кгК), сp = = 1,4610 4 Дж / (кгК).
Рішення. У загальному випадку кількість тепла необхідного для нагрівання суміші газів, наприклад, при нагріванні в умовах постійного обсягу від температури Т1 до температури Т2 дорівнює:
де СV (см) - питома теплоємність суміші;
(T2 -T1) - зміна температури.
З іншого боку це кількість тепла може бути вичісленопо формулою:
де Q1 і Q1 - відповідно кількість тепла, яке необхідно
повідомити, щоб змінити температуру неону і водню в окремо;
сv1 і сv2 - питомі теплоємності неону і водню при постійному обсязі;
m1 і m2 - маси неону і водню.
Таким чином маємо:
де
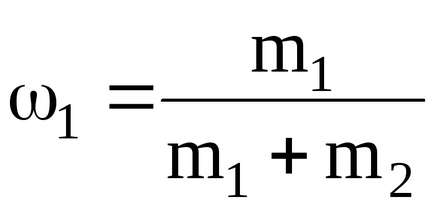
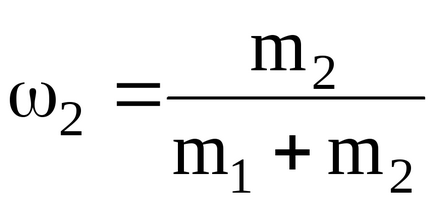
Подставляячісленние значення для удельнойтеплоемкості суміші неону іводорода при постоянномдавленіі, будеміметь:
Аналогічно можна отримати формулу для визначення питомої теплоємності суміші неону і водню при постійному тиску:
Підставляючи чисельні значення для питомої теплоємності суміші при постійному тиску, будемо мати:
1.2.5. Кисень масою 2 кг займає об'єм V1 = 1 м3 і знаходиться під тиском p1 = 0,2 МПа. Газ був нагрітий спочатку при постійному тиску до об'єму V2 = 3 м 3. а потім при постійному обсязі до тиску p3 = 0,5 МПа. Знайти зміну внутрішньої енергії газу.
Рішення. Зміна внутрішньої енергії газу
де cv = iR / 2 - питома теплоємність при постійному обсязі;
- молярна маса газу;
Т = (Т2 - Т1) - зміна температури газу в кінцевому і початковому станах;
i = 5 - число ступенів свободи (кисень двоатомний газ).
Температуру газу в початковому і кінцевому станах можна визначити з рівняння Менделєєва-Клапейрона:
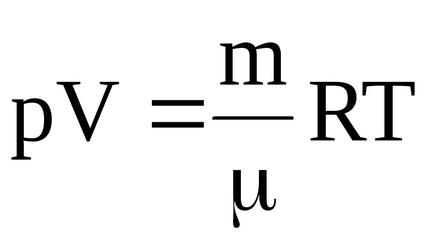
Для початкової температури
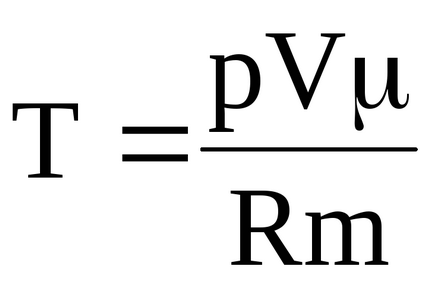
Для кінцевої температури
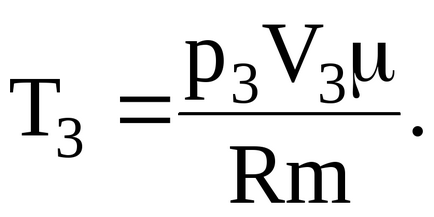
Тоді зміна внутреннейенергіігаза
Подставляячісленние значення, матимемо
1.2.6. Маса m = 10 г кисню знаходиться при тиску p = 0,3 МПа і температурі 10 o С. Після нагрівання при постійному тиску газ зайняв об'єм V2 = 10 л. Знайти кількість теплоти Q, отримане газом, і енергію теплового руху молекул газу W до і після нагрівання.
Рішення. Кількість теплоти Q, отримане газом в процесі нагрівання
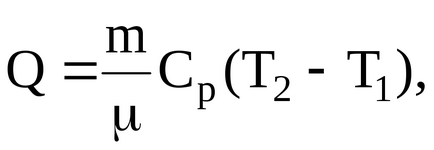
де
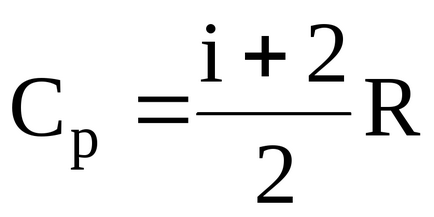
i = 5 - число ступенів свободи (кисень двоатомний газ);
R = 8,31 Дж / (моль7К) - універсальна газова постійна;
= 0,032 кг / моль - молекулярна маса кисню;
T1 і T2 - температури газу в початковому і кінцевому станах. Для визначення температури газу в кінцевому стані скористаємося співвідношенням між температурою і об'ємом газу, що нагрівається в умовах постійного тиску:
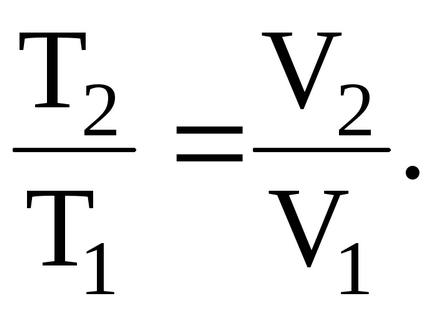
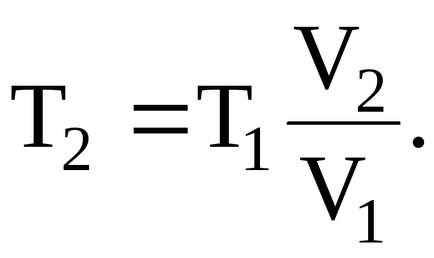
Скориставшись рівнянням Менделєєва-Клапейрона:
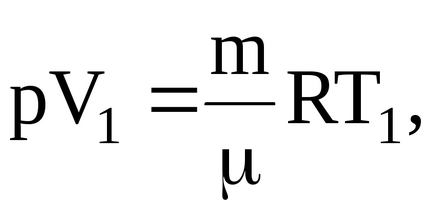
находімоб'ем газу в початковому стані:
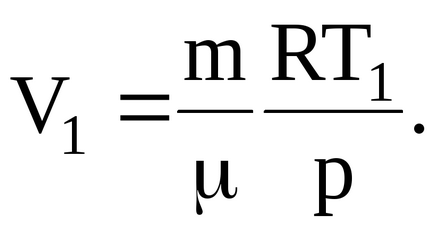
Для кінцевої температури будемо мати співвідношення:
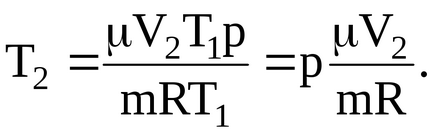
Підставляючи чисельні значення, визначаємо кінцеву температуру газу:
Подставляячісленние значення знаходимо кількість теплоти, отримане газом в процесі нагрівання:
Енергію теплового руху молекул газу можна определітьпо формулою
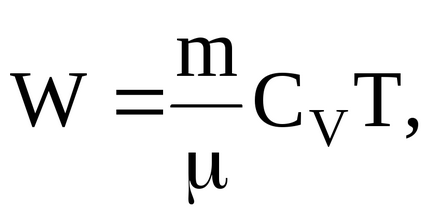
де CV = iR / 2 - молярна теплоємність газу при постійному обсязі.
Таким чином, для енергії теплового руху молекул газу в початковому стані маємо:
в кінцевому стані:
.
1.2.7. Кисень масою 2 кг займає об'єм V1 = 1 м 3 і знаходиться під тиском p1 = 0,2 МПа. Газ був нагрітий спочатку при постійному тиску до об'єму V2 = 3 м 3. а потім при постійному обсязі до тиску p3 = 0,5 МПа. Знайти зміну внутрішньої енергії газу, вчиненим ним роботу і теплоту, передану газу.
Рішення. Відомо, що зміна внутрішньої енергії газу пропорційно зміні його температури, при цьому
З рівняння Менделєєва-Клапейрона
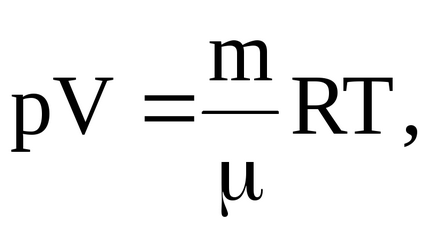
можна визначити температури, характерні для відповідних станів:
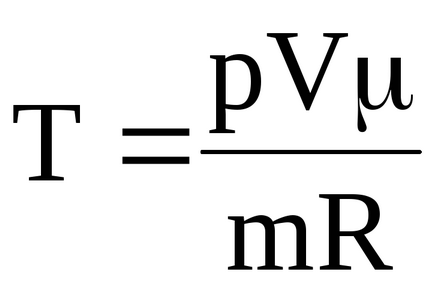
Таким чином, температура газу в початковому стані
Отже, для зміни внутрішньої енергії газу при його переході з початкового стану в кінцевий стан, маємо:
У процесі переходу газ здійснював роботу
де A1 - робота газу, здійснена при переході в умовах постійного тиску;
A2 - робота газу, здійснена при переході в умовах постійного обсягу.
Робота газу, здійснена при переході в умовах постійного тиску визначається співвідношенням:
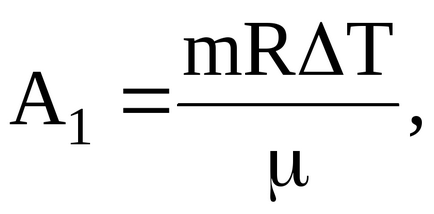
а робота газу, здійснена при переході в умовах постійного обсягу:
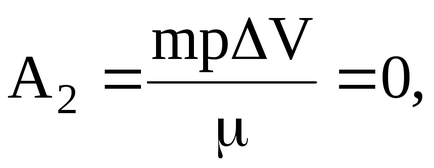
Таким чином, в даному випадку
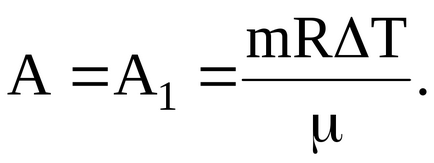
Кількість тепла, переданого газу дорівнює сумі зміни його внутрішньої енергії і роботи, зробленої ним:
Перевіривши розмірність і підставивши чисельні значення величин, матимемо
Т1 = 0,210 6 13210 -3 / 8,3110 3 2 = 385 К;
Т2 = 0,210 6 33210 -3 / 8,3110 3 2 = 1155 К;
Т3 = 0,510 6 33210 -3 / 8,3110 3 2 = 2888 К;
U = 528,31 (2888-385) / 23210 -3 = 3,2510 3 Дж;
A = 28,31 (1155-385) / 3210 -3 = 0,410 3 Дж;
Q = 3,2510 3 + 0,410 3 = 3,6510 3 Дж.
1.2.8. Маса 12 г азоту знаходиться в закритій посудині об'ємом
V = 2 л при температурі t = 10 o С.После нагрівання тиск у посудині стало рівним p = 1,33 МПа. Яка кількість теплоти Q повідомлено газу при нагріванні?
Рішення. Так як обсяг газу не змінився, то повідомлене йому кількість теплоти пішло на зміну його внутрішньої енергії
яке в свою чергу можна визначити так:
де Cv = iR / 2 - молярна теплоємність азоту при постійному обсязі.
Для визначення кінцевої температури T скористаємося тим, що при нагріванні газу умовах постійного обсягу відношення тисків пропорційно відношенню його температур в початковому і кінцевому станах p1 / p2 = T1 / T2.
Начальнoe тиск визначаємо з рівняння Менделєєва-Клапейрона, записаного для початкового стану:
Так як за умовою завдання V1 = V1 = V, то для кінцевої температури маємо:
Підставляючи значення T2 в формулу зміни внутрішньої енергії, яка дорівнює кількості тепла, повідомленою газу, остаточно отримаємо:
Розмірність отриманого результату очевидна. Чисельне значення Q одно
Q = 4,1310 3 Дж = 4,13 кДж.
1.2.9. Балон ємністю V = 20 л з киснем при тиску p = 100 ат і температурі t = 7 o С нагрівається до t = 27 o С. Яка кількість теплоти при цьому поглинає газ?
Рішення. Оскільки коефіцієнти теплового розширення для твердих тіл значно менше (приблизно в сто разів), ніж для газів, в умовах даного завдання можна знехтувати розширенням балона і вважати процес нагрівання газу ізохорним.
При ізохорно процесах, що підводиться до системи кількість тепла йде на зміну її внутрішньої енергії.
З визначення молярної теплоємності випливає, що елементарне кількість теплоти, повідомлене тілу при підвищенні його температури на dT, так само: dQ = CV dT.
Число молей знайдемо з рівняння газового стану (Менделєєва-Клапейрона) = m / = p1 V / RT1.
Так як газ нагрівається при постійному обсязі, то С = СV. де СV = iR / 2.
Підставивши значення і СV в формулу для елементарного кількості тепла, отримаємо:
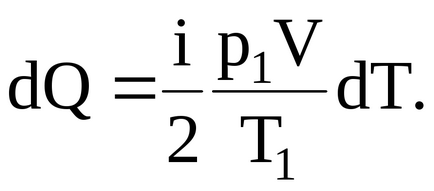
Звідси, інтегруючи і враховуючи при цьому, що всі величини i, p1. T1. V - постійні, знайдемо повне кількість теплоти, поглиненої газом при нагріванні від T1 до T2. яке чисельно і дорівнюватиме ізмененіюего внутрішньої енергії:
Перевіривши розмірність, підставивши в отриману формулу значення входять величин в системі СІ, зробимо обчислення:
U = 59,810 5 210 -3 (300-280) / 2280 = 3510 3 Дж = 35 кДж.