«Таутос» - той же самий, «мерос» - частка, частина (грец.).
Таутомерія - явище динамічного оборотного перетворення ізомерів, що протікає з розривом і освітою зв'язків і супроводжується переміщенням атомів (найчастіше протона) і рідше груп атомів.
Ізомерні форми - таутомери.
На відміну від структурних ізомерів, таутомери, як правило, не можуть існувати окремо один від одного. Незалежне їх отримання неможливо.
Основною ознакою таутомерних речовин є їх двоїсте реагування - здатність до утворення двох рядів похідних як результат роздільного і самостійного реагування двох знаходяться в рівновазі ізомерних форм одного з'єднання.
1. Кето-енольна таутомерія:
2. Амід-імідольная таутомерія:
3. Кільчасто-ланцюгова таутомерія- рівновагу лінійної і кільчастої (полуацетальной форм)
- різновид стереоизомерии, яка визначається різницею просторового розташування в молекулах пари заступників щодо площини подвійного зв'язку або циклу.
Обумовлена тим, що в молекулах цих речовин вільне обертання атомів навколо # 963; -зв'язків (Циклоалкани) і щодо π-зв'язків (алкени) виявляється неможливим.
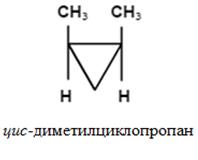
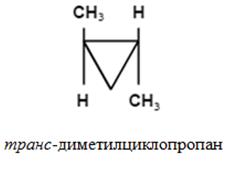
Z, E-номенклатура (для три- і тетразамещенних алкенов).
Конфігурацію ізомери визначають за відносною розташуванню старших заступників. По один бік площини - Z-ізомер; по різні - Е-ізомер.
В основі визначення старшинства знаходиться атомний номер елемента. У разі однакових атомів старшинство групи визначає «друга оболонка» атомів:
У випадках груп з різним типом зв'язку старшинство збільшується в рядах:
-CH2 OH <-COH Внаслідок того, що відстані між заступниками в молекулах ізомерів різні, останні суттєво різняться своїми хімічними і фізичними властивостями. Вони можуть бути розділені і існувати індивідуально. Перехід одного ізомеру в інший - ізомеризація протікає зазвичай при нагріванні або опроміненні. - різновид стереоизомерии, яка визначається різницею просторового розташування в молекулах заступників, що виникає в результаті вільного обертання навколо # 963; -зв'язків. Такі ізомери розрізняються між собою стабільністю. Більш стабільні конформації, які фіксуються фізико-хімічними методами, називаються конформерами. Конформер- це молекула в конформації, в яку її атоми мимовільно повертаються після невеликих зрушень. Зображення конформеров - проекції Ньюмена: Чим більше сила взаємного відштовхування атомів водню, тим вище енергія системи; тому загальмованою конформації буде відповідати мінімум потенційної енергії молекули. Беручи різні конформації, молекули залишаються хімічно однорідними; конформації не є типовими изомерами. Однак, в деяких випадках (при тісному упаковці молекул), можна розділити різні форми. Конформації біоорганічних молекул (ферменти, вітаміни, білки, нуклеїнові кислоти) відіграють визначальну роль в прояві останніми біологічної активності. Коформаціі в ряду циклічних вуглеводнів: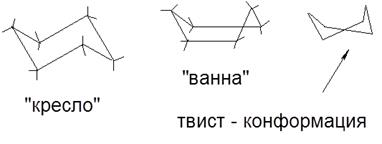
Об'ємні структури циклічних з'єднань містять різні за своєю природою положення заступників:
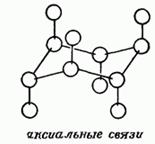
а - аксіальні (поперемінно спрямовані в протилежні сторони від площини кільця)
е - екваторіальні (спрямовані радіально від площини і поперемінно в протилежні сторони)
Деякі органічні сполуки є оптично активними. Вони здатні змінювати площину поляризації світла при проходженні його через зразок речовини (1815 р Ж. Біо).
Світло - електромагнітні хвилі, коливання яких перпендикулярні напрямку їх поширення. У природному (сонячному) світлі ці коливання відбуваються в різних площинах.
Оптично активні сполуки повертають площину поляризації на певний кут вправо (правообертальні) або вліво (левовращающіе).
Ізомери, що обертають площину поляризації в різні боки, але на один і той же кут - антиподи (енантіомери).
Рацемічну суміш (рацемат) - суміш, що складається з рівних кількостей ліво- і правовращающих ізомерів. Рацемат оптично активний.
Оптична активність характерна для сполук містять
sp 3 -гібрідний атом (об'ємні молекули). Якщо такий атом пов'язаний з чотирма різними заступниками, то виникають ізомерні пари, в яких молекули ізомерів відносяться по своїй просторової організації одна до одної так само, як співвідносяться між собою предмет і дзеркальне зображення.
Для того, щоб зв'язати будова з обертанням, було запропоновано вибрати з'єднання-стандарт і порівняти з ним всі інші сполуки, що містять хіральний центр. Як стандарт був обраний
2,3-діоксіпропаналь (гліцериновий альдегід):
Для віднесення стереоізомери необхідно визначити в ньому старшинство заступників (порядковий номер елемента - як у випадку Z, E-ізомерії). Погляд спостерігача спрямовується по осі С-молодший заступник (Н). Після такої орієнтації дивляться, як три заступники розташовуються в ряд в напрямку від старшого до молодшого. У случаеR-конфігурації цей порядок відповідає напрямку руху за годинниковою стрілкою, в случаеS-конфігурації - проти годинникової стрілки.
Якщо молекулі є декілька хіральних центрів, то число ізомерів зростає і дорівнює 2 n. де n - число хіральних центрів.
На відміну від структурних ізомерів енантіомери ідентичні один одному в більшості своїх властивостей. Вони відрізняються тільки по своєму взаємодії з плоскополяризованим світлом і взаємодією з речовинами, які також є хіральними.
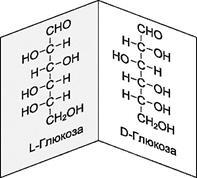
В організмі реакції протікають за участю біокаталізаторів - ферментів. Ферменти побудовані з хіральних молекул # 945; -амінокислот. Тому вони грають роль хіральних реагентів, чутливих до хиральности взаємодіючих з ними субстратів (стереоспеціфічность біохімічних процесів). Це призводить до того, що хіральні природні сполуки представлені, як правило, лише однією стереоізомерной формою (D-вуглеводи, L-амінокислоти).
Стереоспеціфічность лежить в основі прояву біологічної дії одним з енантіомерів, в той час, як інший ізомер може бути неактивним, а іноді здійснювати інший або навіть протилежний ефект.
1.3 Хімічний зв'язок в органічних сполуках
Відповідно до квантово-хімічними уявленнями вуглець в з'єднаннях повинен бути двовалентним.
Однак, в переважній більшості своїх з'єднань атом вуглецю має валентність IV. Це відбувається за рахунок роз'єднання ( «розпарювання») пари електронів з 2s підрівні.
При утворенні хімічного зв'язку виділяється енергія, тому поява двох нових валентних можливостей призводить до виділення додаткової енергії (1053,4 кДж / моль), яка перевершує енергію, витрачену на розпарювання 2s електронів (401 кДж / моль).
Різні за формою орбіталі (s, p) при утворенні зв'язку змішуються, даючи нові рівноцінні гібрідізоваться орбіталі (теорія гібридизації, Л. Полінга, Д.Слетер, 1928-1931 рр.). Поняття гібридизації відноситься тільки до молекул, але не до атомам, і в гібридизацію вступають тільки орбіталі, а не електрони на них.
На відміну від негібрідізованних s- і p- орбіталей гібридна орбіталь полярна (електронна щільність зміщена) і здатна утворювати більш міцні зв'язки.