Мета роботи: визначити показник адіабати для повітря.
Для визначення показника адіабати використовується установка Клемана-Дезорма, схема якої приведена на рис. 1.1.
Мал. 1.1 Установка Клемана-Дезорма
До балону 1 ємністю 10-15 л, в якому знаходиться випробовуваний газ, через кран 4 підключений насос 2, що дозволяє збільшити тиск в порівнянні з атмосферним. Перевищення тиску вимірюється за допомогою U-подібного манометра 3 по різницям рівнів h рідини в колінах. Кран 5 служить для короткочасного випуску газу.
Якщо в балон накачують газ (наприклад, повітря) до тиску Р1. більшого, ніж Р0. то стан газу характеризується параметрами P1. V1. T1 і відповідає точці 1 на PV діаграмі (рис. 1) (Увага! Тут і далі буквою V позначається питома обсяг, тобто обсяг, яку він обіймав одиницею маси газу. Це зручно для розрахунків, тому що за умовами досвіду маса газу в посудині буде змінюватися.)
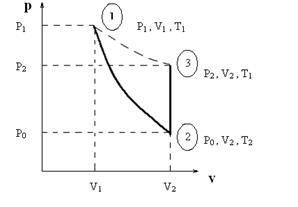
Мал. 1.2. P-V діаграма газових процесів.
Якщо на короткий час відкрити кран балона, то частина газу вийде, а тиск всередині балона знизиться до атмосферного Р0. При цьому розширення газу, внаслідок короткочасності його протікання, можна вважати адіабатичним. тобто що відбувається без теплообміну з навколишнім середовищем; такий процес називають також ізоентропійним. тому при ньому не відбувається зміни ентропії. Новий стан газу буде характеризуватися параметрами P0. V2. T2 (точка 2 на рис. 1). Так як, згідно першому початку термодинаміки, робота газу при адіабатичному процесі відбувається за рахунок зменшення його внутрішньої енергії, то температура газу при цьому знижується, тобто Т2 <Т1. Переход из состояния «1» в состояние «2» описывается уравнением Пуассона для адиабатического процесса, следовательно:
де g - показник адіабати, причому за визначенням він дорівнює:
де Cp - теплоємність газу при постійному тиску,
Cv - теплоємність газу при постійному обсязі.
(Нагадаємо, що молярної теплоємністю називається кількість теплоти, яке потрібно, щоб нагріти 1 моль речовини на 1 К.)
де R = 8,31 Дж / (моль К) - універсальна газова постійна; ставлення Cp / Cv = (i + 2) / i, (1.4)
де i - число ступенів свободи молекул досліджуваного газу: для одноатомного газу i = 3, для двоатомних i = 5, для багатоатомного i = 6.
Через деякий час після закриття крана залишився в балоні газ нагріється при постійному обсязі до температури навколишнього середовища Т1. При цьому його тиск підвищується до значення Р2 (точка 3 на рис. 1). У методі Клемана-Дезорма вимірювання тиску проводять за допомогою U-подібного манометра (див. Рис. 2); перепад h рівнів рідини в колінах манометра дозволяє визначити значення тиску газу в балоні Р1 і Р2 відповідно:
Кінцеве (точка 3) і початкове (точка 1) стану газу відповідають одній і тій же температурі Т1 і пов'язані рівнянням Бойля-Маріотта для ізотермічного процесу:
Щоб отримати формули, що зв'язують показник адіабати з вимірюваними параметрами, зведемо рівняння (1.5) в ступінь g і розділимо його почленно на рівняння (1.1):
Логаріфміруя рівняння (1.7), знаходимо:
Висловимо тиск газу через різницю рівнів рідини в манометрі, підставляючи (1.5) в рівняння (1.8). отримаємо
або після перетворень:
Відносини h1 / P0 і (h1 -h2) / P0 значно менше одиниці, тому, використовуючи наближену формулу ln (1-x) @ x при малих значеннях х. отримаємо з (1.10)
Ця формула є розрахунковою для визначення показника адіабати g.