
Головна | Про нас | Зворотній зв'язок
У природних водах відбувається не одна, а кілька окислювально-відновних реакцій. Ці реакції пов'язані з присутністю елеменов, які здатні змінювати свій заряд в залежності від електричного потенціалу розчину. Тому окислювально-відновний потенціал розчину в цілому визначаться характером і концентрацією цих елементів. Ті компоненти, які помітно впливають на окислювально-відновний потенціалраствора, називають електроактивні. Елементи, концентрація і форма існування яких фактично контролює окислювально-восстано-вітельно потенціал розчину, називають потенціал задають. У природних водах такими можуть бути O, S, C, N і Fe. Розчини, які містять досить високі концентрації таких компонентів і тому майже не змінюють величину окисно-восстано-ник-ного потенціалу при додаванні окислювачів або відновників, називають редокс-буферами.
Окислювально-відновний потенціал розчину в цілому може бути визначений трьома способами:
1 за концентраціями компонентів окремої редокс-пари,
2 безпосередньо за допомогою стандартного водневого електрода і
3 по відносним вмістом електроактивних компонентів в розчині.
1. У першому випадку окислювально-відновний потенціал визначається за відносними концентрацій компонентів однієї Родекс-пари. Зазвичай такі пари вибирають серед перехідних металів, найчастіше Fe 3+ і Fe 2+. Ці метали не завжди є потенціал задають, але вони відносно швидко досягають рівноважних концентрацій, які визначаються величиною Eh розчину. Цей метод оцінки величини Eh показаний на прикладі II-6.
У прісній воді виявили 10 -3,3 моль / л Fe 2+. і 10 -5,9 моль / л Fe 3+. Треба визначити величину Eh розчину.
Припустимо, що концентрації цих іонів заліза врівноважені. Вони взаємодіють згідно полуреакции: Fe 3+ + e - = Fe 2+. Стандартний електродний потенціал цієї реакції 10. lg KFe = -13, ze = 1. У прісній воді коефіцієнти активності можна прирівняти до 1.
Можливі два рішення.
Спосіб 1: При рівновазі справедливо рівняння:
.
Тоді. Eh = 0,059 # 8729; 10,4 = 0,61 В.
Спосіб 2: Відповідно до рівняння Нернста
= 0,771- 0,059 lg (10 -3,3 # 8729; 10 +5,9) = 0,77- 0,15 = 0,62 В
Отже вода має окислювально-відновний потенціал +0,62 В, що на 0,15 В нижче, ніж потрібно для рівноваги. Такий розчин відчуває дефіцит електронів і є окислювачем.
Однак окислювально-відновні реакції в розчині йдуть з різною швидкістю, величина якої часто залежить від змісту і характеру мікроорганізмів. Найбільш швидкими вважаються лише окислювально-відновні реакції між металами (наприклад, Fe 2+ ↔Fe 3+. Sn 2+ ↔Sn 4+ і т.д.), періоди напіврозпаду яких вимірюються хвилинами або годинами. Редокс-реакції з аніонами, особливо з органічною речовиною за участю O2 і гідролізу, йдуть значно повільніше. Це викликано тим, що ці реакції мають високі енергії активації, пов'язані з руйнуванням міцних ковалентних зв'язків. Багато з таких окисно-відновних процесів в природних умовах реалізуються тільки за рахунок біохімічного каталізу (наприклад, N2 → NO2 - → NO3 -). Швидкості таких процесів дуже низькі і нестабільні: мікробні популяції повинні пристосуватися до середовища і вступити в безпосередній контакт з редокс парами. Лише окислення сульфідної сірки в лужному середовищі можна віднести до досить швидким процесам. Багато окислювально-відновні реакції занадто повільні через надзвичайно великих констант рівноваги, і по суті є незворотними. Період напіврозпаду таких реакцій може досягати декількох років. З цієї величину Eh окремих редокс-пар рідко коли може бути критерієм окислювально-відновного потенціалу розчину в цілому.
Однак, цей метод використовують для визначення потенціалу редокс-буфера, який, як правило, висловлюють величиною рівноважної фугітівності кисню. В цьому випадку кисень використовується в якості донора електронів в окислювально-відновних реакціях. Тоді реакція окислення заліза має вигляд:
а окислення сірки:
Тут активність кисню використовується як показник або індекс редокс-умов, незалежно від того, чи є кисень в системі або його немає. В умовах рівноваги остання реакція має активності, пов'язані величиною константи рівноваги:
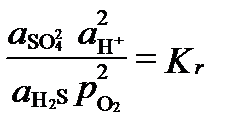
Окислювально-відновний потенціал цієї рівноважної обстановки можна висловити величиною фугітівності кисню, яка при Kr = 10 126 і pH = 7 дорівнює:
Зазвичай потенціал редоекс-буфера визначають по співвідношенню мінеарльних форм елементів різного ступеня окислення. В осадових породах як його показника використовуються реакція перетворення магнетиту в гематит:
Окислювальна обстановка умов осадкообразованія і діагенеза зазвичай харакьерізуется фугітівності кисню від 0,2 атм на поверхні до 10 -70 атм в стандартних умовах.
2. Визначення величини Eh розчину за допомогою стандартного водневого електрода видається більш вірогідним. В цьому випадку окислювально-відновний потенціал визначають безпосередньо в воді, порівнюючи його з потенціалом стандартного водневого електрода. величина якого прийнята рівною 0. Пристрій цього електрода представлено на рис. II-8
Малюнок II-17. Принцип зіставлення Eh розчину з потенціалом стандартного водневого електрода. А- випробувана вода, B - стандартний водневий електрод.
Величини Eh, виміряна таким способом, характеризують відхилення деякого усередненого, не обов'язково врівноваженого, потенціалу # 8710; Eраств. розчину в цілому від потенціалу стандартного водневого електрода:
При цьому необхідно мати на увазі, що в реальних умовах потенціал водневого електрода НЕ дорівнює 0. Його потенціал визначається рівнянням:
Якщо E 0 H = 0,0 В, а = 1 атм, то:
Коефіцієнти активності звичайних кислот досить добре вивчені. Тому при температурі 25 o C і = 1 атм:
Це рівняння характеризує поправку, яка зазвичай враховується автоматично і мінімізує помилки визначення Eh розчину внаслідок нестабільності pH водневого електрода.
Крім того, при вимірюванні Eh елетроди необхідно враховувати вплив взаємодії електрода з опробуемого водою, а саме його корозію або адсорбцію дисперсного речовини на його поверхні. Наприклад, при зануренні в безкисневому воду багату Fe 2+ електрода з адсорбованим O2 на його поверхні може осідати FeOOH, що помітно впливає на його електроактивних. Вимірювання Eh електродним методом найбільш достовірні при дослідженні кислих вод з високими концентраціями Fe 2+ і Fe 3+.
Величини Eh, заміряні з використанням стандартного електрода, містять в собі деяку невизначеність. Очевидно, що розчини з більшою величиною Eh грають роль окислювача по відношенню до розчинів з меншою величиною Eh. Але це не означає, що всі редокс-реакції розчину знаходяться в рівновазі, і мають однакову величину окисно-відновного потенціалу.
З цієї причини величини Eh (pe), розраховані за різними Родекс-парам одного і того ж розчину і електродним методом дають широкий розкид значень. У більшості випадків результати, отримані електродним методом, погано можна порівняти з резултат, отриманими за Родекс-парам. Це видно на малюнку II-9, де величини Eh, заміряні в поле електродним методом, зіставляються з величинами Eh, розрахованими по Родекс-парам.
Основна причина цього розкиду полягає у відсутності в природних водах повного рівноваги окисно-відновних реакцій. Тому величини Eh електродного методу, як правило, не можуть бути віднесені до будь-якої конкретної редокс-парі і використані для інтерпретації взаємодії її компонентів. Винятком може бути випадок, коли використовується електрод чутливий тільки до однієї Родекс-парі. І навпаки, величина Eh, розрахована за концентраціями окремої редокс-пари, не може бути використана для характеристики окисно-відновного потенціалу розчину в цілому.
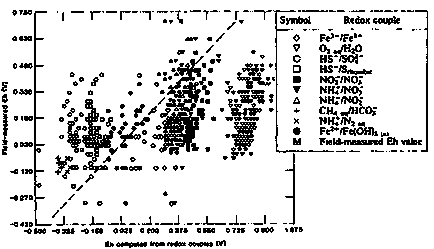
Малюнок II-18. Зіставлення польових електродних вимірів Eh в підземних водах з потенціалами розрахованими по окремим Родекс-парам (Lindberg, R.D. Runnells, D.D. 1984).
3. Нарешті, окислювально-відновний потенціал розчину можна розрахувати, якщо відомі всі редокс-пари його складу і допускається їх повне хімічне рівновагу.
Дійсно, якщо є J Родекс-реакцій, які йдуть одночасно і вимагають по ve, j електронів на кожен акт обміну, то загальна кількість електронів, задіяних в окисно-восстано-ві-них процесах розчину, так само. Тоді максимальна корисна робота всіх гальванічесіх мікроелементів розчину, відповідно до рівняння II-149, дорівнює:
У той же час мінімальна вільна ентальпія всіх цих реакцій, відповідно до рівняння II-91, дорівнює:
де і - величини стандартних молярних потенціалів вільної ентальпії продуктів і реагентів всіх редокс-реакцій, - мінімальні вільні ентальпії цих реакцій при рівновазі, ve, j - число електронів беруть участь в цих реакціях. Порівнюючи два останніх рівняння, отримаємо:
CO2 + 2H + + 2e = CO + H2 O (= - 0,104 В)
CO + 2H + + 2e = C + H2 O (= 0,518 В)
CO2 + 4H + + 4e = C + 2H2 O (= (2 × 0,518-2 × 0,104) / 4 = 0,207 В)
Величина характеризує загальний окислювально-відновний потенціал розчину в умовах його повного хімічного рівноваги. Однак, ця рівновага в природних водах, як правило, відсутня внаслідок великої різниці в швидкостях редокс-реакцій. У зв'язку з цим для оцінки реального значення Ehраств. розчину необхідно враховувати реальні активності (концентрації) компонентів, що беруть участь в редокс-реакціях ратвора. Тоді відповідно до рівнянь II-150 і II-153 Eh розчину в цілому одно: