Трансмембранної ПЕРЕДАЧА СИГНАЛУ
Важлива властивість мембран - здатність сприймати і передавати всередину клітини сигнали із зовнішнього середовища. "Розпізнавання" сигнальних молекул здійснюється за допомогою білків-рецепторів, вбудованих в клітинну мембрану клітин-мішеней або знаходяться в клітці. Клітину-мішень визначають по здатності вибірково зв'язувати цю сигнальну молекулу за допомогою рецептора.
Якщо сигнал сприймається мембранними рецепторами, то схему передачі інформації можна уявити так:
взаємодія рецептора з сигнальної молекулою (первинним посередником);
активація мембранного ферменту, відповідального за освіту вторинного посередника;
освіту вторинного посередника цАМФ, цГМФ, ІФ3, ДАГ або Са 2+;
активація посередниками специфічних білків, в основному протеинкиназ, які, в свою чергу, фосфоріліруя ферменти, впливають на активність внутрішньоклітинних процесів.
Незважаючи на величезну різноманітність сигнальних молекул, рецепторів і процесів, які вони регулюють, існує всього декілька механізмів трансмембранної передачі інформації: з використанням аденілатціклазной системи, інозітолфосфатной системи, каталітичних рецепторів, цитоплазматических або ядерних рецепторів.
Сигнальні молекули - гормони, медіатори, фактори росту, NO
Сигнальними молекулами можуть бути неполярні і полярні речовини. Неполярні речовини, наприклад стероїдні гормони, проникають в клітку, проходячи через ліпідний бішар. Полярні сигнальні молекули в клітину не проникають, але зв'язуються специфічними рецепторами клітинних мембран. Така взаємодія викликає ланцюг послідовних подій в самій мембрані і всередині клітини. До полярних сигнальним молекулам відносять білкові гормони (глюкагон, інсулін), нейромедіатори (ацетилхолін, гліцин, γ-аміномасляна кислота), фактори росту.
За локалізацією розрізняють мембранні, цитоплазматические і ядерні рецептори. За іншою класифікацією всі рецептори можна розділити на бистроотвечающіе (в межах мілісекунд) і медленноотвечающіе, в межах декількох хвилин або навіть годин, що характерно для гормонів, що передають сигнал на внутрішньоклітинні рецептори. Рецептори першого типу - інтегральні олігомерні білки, що містять субодиницю, що має центр для зв'язування сигнальної молекули і центральний іонний канал.
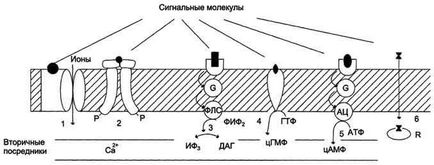
Участь рецепторів в трансмембранної передачі сигналу.
Рецептори: 1 - пов'язані з іонними каналами, наприклад рецептор ГАМК; 2 - з каталітичної активністю (рецептор інсуліну); 3 - передають сигнал на фосфоліпазу С, наприклад α1-адренорецепторів; 4 - з каталітичної активністю (гуанілатциклазу, рецептор ПНФ- передсердно натрійуретичного фактора); 5 - передають сигнал на аденілатциклазу, наприклад β-адренорецептори; 6 - зв'язуючі гормон в цитоплазмі або ядрі, наприклад рецептор кортизолу.
Рецептори другого типу. локалізовані в мембранах і не пов'язані з каналами, підрозділяють на 2 великі групи: каталітичні рецептори, що володіють власною тірозінкіназной або гуанілатціклазной активністю, і рецептори, що взаємодіють через G-білок з мембранним ферментом. Зв'язування ліганда (наприклад, гормону) з рецептором на зовнішній стороні клітинної мембрани призводить до зміни активності цитоплазматического ферменту, який, в свою чергу, ініціює клітинну відповідь, тобто через мембрану переноситься інформація, а не заряди або розчинені молекули.
У разі цитоплазматических рецепторів через мембрану проходить гормон, а інформація про присутність гормону в клітці за допомогою рецептора передається в ядро.
Різні клітини організму в залежності від виконуваних ними функцій мають певний набір рецепторів. У мембрані однієї клітини може бути більше десятка різних типів рецепторів. Взаємодіючи з рецептором, позаклітинні хімічні посередники впливають на метаболізм та функціональний стан (проліферація, секреція і т.д.) клітин-мішеней.
Взаємодія гормонів з рецепторами, сполученими з G-білками, призводить до активації аденілатціклазной або інозітолфосфатной регуляторних систем.
За участю аденілатціклазной системи реалізуються ефекти сотні різних за своєю природою сигнальних молекул - гормонів і нейромедіаторів.
Функціонування системи трансмембранної передачі сигналів забезпечують 5 білків.
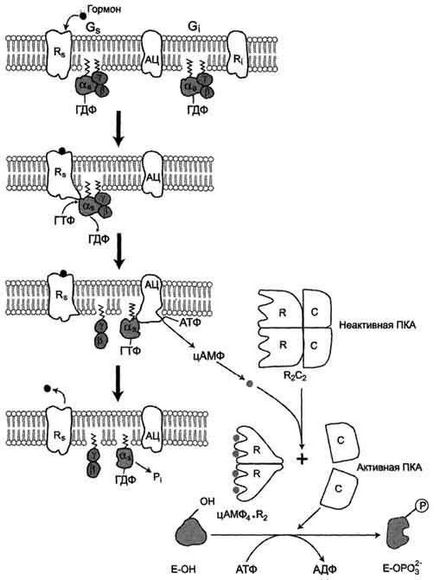
Інтегральні білки мембрани цитоплазми: Rs-рецептор активатора аденілатціклазной системи і Ri рецептор інгібітора аденілатціклазной системи
«Заякоренниве білки»: Gs -ГТФ-зв'язуючий білок, складається з αs. β, γ-субодиниці і Gj -ГТФ-зв'язуючий білок, складається з αi. β, γ-субодиниці і одного цитозольного ферменту протеїнкінази А (ПКА).
Послідовність подій, що призводять до активації аденілатциклази:
Рецептор має два центри зв'язування: для гормону на зовнішній поверхні мембрани і для G-білка на внутрішній поверхні мембрани.
Взаємодія активатора аденілатціклазной системи, наприклад гормону з рецептором (Rs), призводить до зміни конформації рецептора
Збільшується спорідненість рецептора до Gs -белку. Утворюється комплекс гормон-рецептор.
Приєднання комплексу гормон-рецептор до Gs -ГДФ знижує спорідненість α-субодиниці Gs -белка до ГДФ і збільшує спорідненість до ГТФ. В активному центрі αs -субодиниці ГДФ заміщується на ГТФ;
Це викликає зміна конформації αs -субодиниці і зниження спорідненості до βγ-субодиницям
Відокремилася αs -ГТФ субодиниця латерально переміщається в ліпідному шарі мембрани до центру зв'язування ферменту аденілатциклази
Взаємодія αs - ГТФ субодиниці заденілатциклази призводить до зміни конформації ферменту, його активації і збільшення швидкості утворення цАМФ з АТФ;
У клітці підвищується концентрація цАМФ - вторинного посередника гормонального сигналу
Молекули цАМФ можуть оборотно з'єднуватися з регуляторними субодиницями протеїнкінази А, яка складається з 2 регуляторних і 2 каталітичних субодиниць
Приєднання цАМФ до регуляторних субодиниць викликає дисоціацію комплексу, каталітичні субодиниці відокремлюються і стають активними
Активна протеинкиназа А за допомогою АТФ фосфорилирует специфічні
білки по серину і треоніну, в результаті змінюються конформація і активність
фосфорильованих білків, а це призводить до зміни швидкості і напряму
регульованих ними процесів в клітині.
Каскадний механізм посилення і придушення сигналу. Передача сигналу від мембранного рецептора через G-білок на фермент аденілатциклазу служить прикладом каскадної системи посилення цього сигналу. Одна молекула, що активує рецептор, може "включати" кілька G-білків, і потім кожен активує кілька молекул аденілатциклази з утворенням тисяч молекул цАМФ. На цьому етапі сигнал посилюється в 10 2 -10 3 разів. Утворений цАМФ "включають" інший фермент - протеїн А, посилюючи сигнал ще в 1000 разів. Фосфорилювання ферментів протеїнкіназою А ще більше підсилює сигнал, в результаті сумарне посилення одно 10 6 -10 7 разів. Таким чином, за механізмом каскадного посилення одна молекула регулятора здатна змінити активність мільйонів інших молекул.
Інозітолфосфатная система включає 3 мембранних білка:
R- рецептор активатора інозітолфосфатной системи - інтегральний білок
Фосфоліпаза С - поверхневий білок
Gplc - ГТФ-зв'язуючий білок активує фосфоліпазу С - заякоренних білок
Роботу системи забезпечують білок кальмодулін, фермент протеїн кіназа С, регульовані Са 2+ -канали мембрани ЕПР, Са 2+ -АТФаза клітинної та мітохондріальної мембран
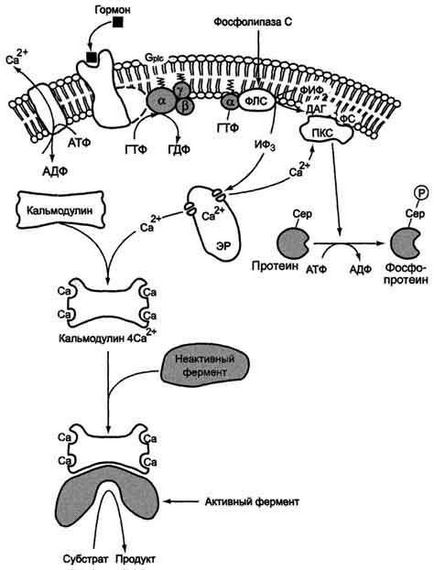
Послідовність подій, що призводять до активації фосфоліпази С:
зв'язування сигнальної молекули, наприклад гормону з рецептором (R), викликає зміна конформації і збільшення спорідненості до Gр1с -белку.
освіту комплексу гормон-рецептор Gрlс -ГДФ призводить до зниження спорідненості αрlс -протомера Gрlс -белка до ГДФ і збільшення спорідненості до ГТФ. В активному центрі αрlс -субодиниці ГДФ замінюється на ГТФ.
це викликає зміна конформації αрlс -субодиниці і вона відділяється від βγ-
відокремилася α- ГТФ субодиниця латерально переміщається по мембрані до центру зв'язування ферменту фосфоліпази С.
взаємодія α- ГТФ субодиниці з фосфоліггазой З змінять конформацию і активність ферменту, збільшується швидкість гідролізу фосфоліпідів клітинної мембрани фосфатидилинозитол-4,5-бісфосфат (ФІФ2).
в ході гідролізу утворюється і виходить в цитозоль гидрофильное речовина інозитол-1,4,5-трифосфат (ІФ3). Інший продукт реакції диацилглицерол (ДАГ) залишається в мембрані і бере участь в активації ферменту протеїнкінази С (ПКС).
инозитол-1,4,5-трифосфат (ІФ3) зв'язується специфічними центрами Са 2+ -каналу мембрани ЕР, це призводить до зміни конформації білка і відкриття Са 2+ -каналу. Са 2+ по градієнту концентрації надходить в цитозоль. За відсутності в цитоплазмі ІФ3 канал закритий.
Активація протеїнкінази С
Підвищення концентрації Са 2+ в цитоплазмі клітини збільшує швидкість взаємодії Са 2+ з неактивним цитозольним ферментом протеїнкіназою С (ПКС) і білком кальмодулином.
Зв'язування протеїнкінази С з іонами кальцію дозволяє ферменту вступати в кальцій-опосередкована взаємодія з молекулами "кислого" фосфолипида мембрани, фосфатидилсерина (ФС). Диацилглицерол, займаючи специфічні центри в протеїнкінази С, ще більш збільшує її спорідненість до іонів кальцію.
На внутрішній стороні мембрани утворюється ферментативний комплекс - (ПКС ▪ Са 2+ ▪ ДАГ ▪ ФС) - активна протеинкиназа С, фосфорилюється специфічні ферменти по серину і треоніну.
Участь білка кальмодулина в інозітолфосфатной передачі сигналу
У клітинах багатьох тканин присутній білок кальмодулін, який функціонує як внутрішньоклітинний рецептор Са 2+. він має 4 центри для зв'язування Са 2+. При підвищенні концентрації кальцію він приєднується до кальмодуліном, утворюючи комплекс (4СА 2+ -кальмодулін) і цей комплекс взаємодіє з різними білками і ферментами призводить до їх активації, підвищуючи швидкість фосфорилювання по серину і треоніну.
Як і більшість систем трансмембранної передачі сигналів, інозітолфосфатная система має не тільки механізм посилення, але і механізм придушення сигналу. Присутні в цитозолі інозитол-1,4,5-трифосфат (ІФ3) і диацилглицерол (ДАТ) в мембрані можуть в результаті серії реакцій знову перетворюватися в фосфатидилинозитол-4,5-бісфосфат (ФІФ2). Ферменти, що каталізують відновлення фосфолипида, активуються фосфорилюванням протеїнкіназою С.
Концентрація Са 2+ в клітці знижується до вихідного рівня при дії Са 2+ -АТФ-аз цитоплазматичної мембрани і ЕР, а також Na + / Ca 2+ -і Н + / Са 2+ -транслоказ (активний антіпорт) клітинної та мітохондріальної мембран .
Функціонування транслоказ Са 2+ і Са 2+ -АТФ-аз може активуватися:
комплексом (4СА 2+ -кальмодулін);
протеїнкіназою А (фосфорилюванням);
протеїнкіназою С (фосфорилюванням). Зниження концентрації Са 2+ в клітці і діацілгліцерола в мембрані призводить до зміни конформації протеїнкінази С, зниження її спорідненості до фосфатидилсерину, фермент дисоціює в цитозоль (неактивна форма). Фосфорильовані протеїнкіназою З ферменти і білки під дією фосфопротеінфосфатази переходять в дефосфорілірованном форму.
Рецептори з гуанілатціклазной активністю
Гуанілатциклазу каталізує утворення цГМФ з ГТФ, одного з важливих посередників внутрішньоклітинної передачі сигналу.
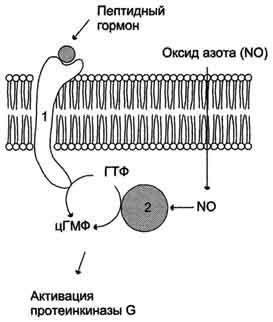
Регуляція активності мембранної (1) і цитозольних (2) гуанілатциклази.
Гуанілатциклазу знаходиться в клітці, як в мембранно-зв'язаному стані, так і в цитозольні. Співвідношення цих двох форм ферменту в різних тканинах різний. Наприклад, в клітинах тонкого кишечника 90% гуанілатциклази знаходиться в мембранах, а в легенях і печінці - лише 20%. Цитозольні і мембранно-пов'язана гуанілатциклази розрізняються не тільки по локалізації, а й за молекулярною масою, активності, способу регуляції.
Цитозольні форма гуанілатциклази складається з двох субодиниць (α і β) і містить в своєму складі простетичної групу - гем. В області гема зв'язується активатор цієї форми гуанілатциклази - оксид азоту (NO), що утворюється з аргініну під дією ферменту синтази оксиду азоту.
Мембранно-пов'язана гуанілатциклазу - трансмембранний глікопротеїн. Внутрішньоклітинний домен гуанілатциклази проявляє каталітичну активність, позаклітинний домен служить рецептором. Приєднання активатора до рецептора викликає зміна конформації в мембранному і цитозольних доменах і, як наслідок, активацію гуанілатциклази. У тканинах людини присутні 3 типу мембранно-пов'язаних гуанілатциклазу, в активації яких беруть участь специфічні регулятори - передсердний натрійуретичний фактор (ПНФ), натрійуретичний пептид з мозку і кишковий пептид гуанілін.
У клітинах тканин виявлені 3 основних типи внутрішньоклітинних рецепторних білків, з якими взаємодіє цГМФ: цГМФ-залежна протеинкиназа (протеинкиназа G), цГМФ-регульовані іонні канали та цГМФ-регульована фосфодіестерази, специфічна до цАМФ (каталізує перетворення цАМФ в АМФ).
цГМФ грає важливу роль в регуляції Са 2+ -гомеостаза в різних типах клітин. Підвищення концентрації цГМФ призводить до зниження концентрації Са 2+ як в результаті активації Са 2+ -АТФ-аз, так і за рахунок придушення рецепторзавісімого надходження цього іона в цитоплазму клітини. Ці ефекти опосередковані дією протеїнкінази G на мембранні білки, які беруть участь в обміні Са 2+.
Передача сигналу за допомогою внутрішньоклітинних рецепторів
Передача сигналу ліпідорозчинним стероїдних гормонів і тироксину можлива тільки при проходженні цих гормонів через плазматичну мембрану клітин-мішеней.
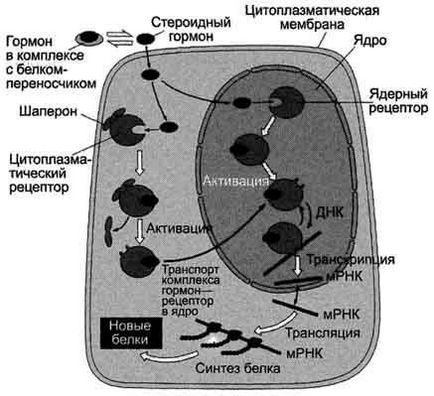
Передача сигналу на внутрішньоклітинні рецептори.
Рецептори гормонів можуть перебувати в цитоплазмі або в ядрі. Цитозольні рецептори пов'язані з білком-шаперон, який запобігає передчасну активацію рецептора. Ядерні і цитозольні рецептори стероїдних і тиреоїдних гормонів містять ДНК-зв'язуючий домен, який забезпечує в ядрі взаємодія комплексу гормон-рецептор з регуляторними сайтами ДНК.
Послідовність подій, що призводять до експресії специфічних білків:
гормон проходить через подвійний ліпідний шар клітинної мембрани і взаємодіє з рецептором.
комплекс гормон-рецептор проходить в ядро, взаємодіє з регуляторної нуклеотидной послідовністю в ДНК - енхансером або сайленсери.
збільшується (при взаємодії з енхансером) або зменшується (при взаємодії з сайленсери) доступність промотора для РНК-полімерази.
відповідно збільшується або зменшується швидкість транскрипції структурних генів.
зрілі мРНК виходять з ядра
збільшується або зменшується швидкість трансляції.
змінюється кількість білків, які можуть впливати на метаболізм і функціональний стан клітини.
Ефекти гормонів, які передають сигнал через внутрішньоклітинні рецептори, не можна спостерігати відразу, так як на перебіг матричних процесів (транскрипцію і трансляцію) потрібен час.
Для дослідників, що мають уявлення про кількість сигнальних молекул, про відповідній кількості рецепторів, про трансмембранних системах передачі сигналів, вторинних посередників, залишається загадкою, як протеїнкінази вибирають відповідний фермент метаболічного шляху для фосфорилювання. Дослідники для пояснення цього явища пропонують "гіпотезу мішені". За цією гіпотезою специфічність протеинкиназ і фосфопротеінфосфатаз досягається шляхом освіти компартментов на мембрані, до складу яких входять не тільки самі протеїнкінази і фосфопротеінфосфатази, але і специфічні білки-субстрати. Наявність залишку миристиновой або пальмітинової кислоти в структурі білків-субстратів - умова їх "заякоріванню" у відповідному мембранном компартменте.
Однак в більшості випадків процес активації будь-якого метаболічного процесу знаходиться під контролем не однієї, а кількох систем внутрішньоклітинної сигналізації, тому важливим фактором відповіді клітин служить взаємозв'язок цих систем.