Ковалентний зв'язок - зв'язок між двома атомами, які з'єднуються один з одним за рахунок утворення ЗАГАЛЬНОЇ електронної пари.
Існує два можливих механізму утворення спільної електронної пари:
· Обмінний механізм, коли кожен з взаємодіючих атомів надає в пару по одному електрону,
· Донорно-акцепторні механізм. якщо один з атомів надає електронну ПАРУ, а інший - порожню (вакантну) орбиталь.
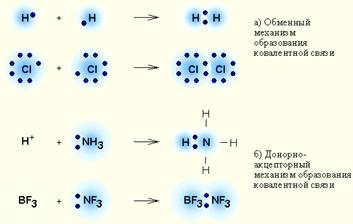
# 8252; По донорно-акцепторного механізму утворені зв'язку в наступних речовинах:
1. Всі комплексні сполуки;
4. Гази СО - чадний газ, О3 - озон.
Електронегативність (ЕО) - здатність атома притягати електрони при утворенні хімічного зв'язку. Таким чином, електрон зміститься до атому того елемента, який має велику електронегативність.
Можливо три випадки для двох атомів А і В, що утворюють зв'язок: А-В
1) ЕО (А) = ЕО (В) (різниця електронегативності дорівнює нулю).
Загальна електронна пара не зміщена ні до одного з атомів. Чи не виникає полюсів, електронна щільність у обох атомів однакова.
Це НЕПОЛЯРНАЯковалентная зв'язок.
# 8252; Приклади неполярной ковалентного зв'язку: а) двоатомні прості речовини. H-H, F-F,
б) симетричні молекули типу Н2О2 (Н-О-О-Н) - зв'язок між двома атомами кисню і т. п.
При утворенні ковалентного зв'язку електронна пара зміщена до більш електронегативного атома А. на ньому виникає частковий негативний заряд, а на В - частковий позитивний.
Такий зв'язок називається ковалентним полярних.
# 8252; Такий тип зв'язку характерний для молекул (або частин молекул), що складаються з двох і більше неметалів (HCl, H2O, СН3СООН).
Чим більше різниця ЕО, тим вище полярність зв'язку (при цьому електронна пара належить обом атомам). Наприклад, в ряду НСl à HBr à HI полярність зв'язку зменшується.
3) ЕО (А) >> ЕО (В).
Різниця електронегативності настільки велика, що атом В (метал) віддає свій електрон атома В (неметалл). Виникають ІОНИ - катіон В + і аніон А-.
Такий зв'язок називається іонної.
Іонна зв'язок-граничний випадок ковалентного полярного зв'язку.
# 8252; Такий тип зв'язку характерний для сполук металів з неметалами, оксидів металів, підстав і солей, в тому числі солей органічних і солей амонію.
В іонному кристалі немає молекул. Кожен іон оточений певним числом іонів іншого знака.
Іонна зв'язок характеризується ненаправленим і ненасиченістю. Речовини з іонним зв'язком мають іонну кристалічну решітку.
# 8252; Необхідно пам'ятати, що існують речовини, в молекулі яких одночасно присутні і іонні, і ковалентні зв'язки (наприклад, NaOH, KNO3).
3. Металева зв'язок виникає в простих речовинах - металів між позитивно зарядженими іонами металу і вільно рухаються електронами ( «електронний газ»). Наявність такого вільного руху електронів є причиною хорошою тепло - і електропровідності металів.
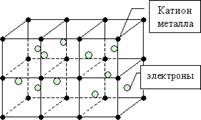
Атоми металів відрізняються від атомів інших елементів тим, що порівняно слабо утримують свої зовнішні електрони. Тому ці електрони залишають свої атоми, перетворюючи їх в позитивно заряджені іони. "Усуспільнення" електрони пересуваються в просторі між катіонами металів і утримують їх разом.
Водневий зв'язок - це зв'язок не всередині молекули, а між молекулами або між незалежними частинами молекул.
Водневий зв'язок - виникає між сильно електронегативними атомами (зазвичай водню або фтору, рідше азоту) і атомом водню іншої молекули або частини молекули:
(Суцільний рисою позначена ковалентний зв'язок, точками - воднева зв'язок).
Наявність водневих зв'язків призводять до аномального підвищення температур кипіння у речовин, в яких вона присутня.
Температури кипіння водневих з'єднань неметалловVIА групи
Ступінь окислення - гіпотетичний заряд у атома в молекулі, розрахований, виходячи з припущення про іонному характер всіх зв'язків і з того, що в цілому молекула електронейтральна.
Довжина, енергія (міцність) і полярність зв'язку.
Довжина зв'язку - відстань між ядрами атомів в з'єднанні.
А) від радіусів атомів, що утворюють зв'язок
Б) від кратності зв'язку (одинарна, подвійна, потрійна).
Звичайно чим більше довжина зв'язку, тим менше її енергія (міцність).
Зв'язок вважається міцною, якщо її енергія перевищує 500 кДж / моль (наприклад, 942 кДж / моль для N2), слабкою - якщо її енергія менше 100 кДж / моль (наприклад, 69 кДж / моль для NO2).
Якщо атом пов'язаний з іншими атомами однакові зв'язку, але при їх утворенні беруть участь орбіталі різного типу, то використовується метод гібридизації.
Приклад: Молекула СН4 має форму правильного тетраедра, в ній все 4 зв'язку мають однакову довжину, міцність, знаходяться під однаковими кутами один до одного.
Однак у четирехвалентного атома вуглецю електрони розташовані на трьох р-орбіталях і однієї s-орбіталі. Вони різні за енергії, формі і розташовані в просторі інакше.
Для пояснення використовується поняття гібридизації:
з чотирьох атомних орбіталей утворюються 4 нових,
гібридних орбіталі, які в просторі розташовуються НА максимальному видаленні ОДИН ВІД ОДНОГО. Це правильний тетраедр, кути між зв'язками рівні 109 ° 29'.
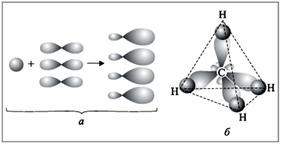
Так як в освіті чотирьох зв'язків беруть участь одна s і три р-оболонки, то такий тип гібридизації позначається sp3
Залежно від числа і типу орбіталей, які беруть участь в гібридизації, відрізняють наступні типи гібридизації:
1) sp-гібридизація. Беруть участь одна s-орбіталь і одна р-орбіталь. Молекула має лінійну структуру, валентний кут - 1800.
2) sp2-гібридизація. Беруть участь одна s-орбіталь і дві р-орбіталі. Молекула розташовується в площині (кінці гібридних орбіталей направлені до вершин рівностороннього трикутника), валентний кут - 1200.
3) sp3-гібридизація. Беруть участь одна s-орбіталь і три р-орбіталі. Молекула має тетраедричних форму, валентний кут - 109,280.
4) sp3d-гібридизація. Форма молекули - трігональная біпіраміди.
5) sp3d2-гібридизація, приклад - SF6. Форма молекули - октаедр.
Як визначити тип гібридизації?
1. У гібридизації беруть участь сигма-зв'язку і неподіленої ІОННІ ПАРИ.
2. Загальна кількість беруть участь орбіталей - визначає тип гібридизації.
Завдання: визначити тип гібридизації атома вуглецю в молекулі фосгену.
1) вуглець утворює 2 одинарні зв'язку (це сигма-зв'язку) і одну подвійну зв'язок (сигма + пі) .Все 4 електрона вуглецю беруть участь в утворенні цих зв'язків.
2) таким чином, в гібридизації візьмуть участь ТРИ СІГМА-зв'язку. Це sp2-гібридизація. молекула має форму плоского трикутника. Пі-зв'язок розташовується перпендикулярно площині цього трикутника.
Контрольні питання по темі Будова речовини.
1. Які механізми утворення ковалентного зв'язку? Яку зв'язок ми називаємо ковалентного?
2. Чим відрізняється іонна зв'язок від ковалентного?
3. Що таке валентність? Як визначається валентність атомів?
4. У яких атомів вища валентність не дорівнює номеру групи?
5. Полярність зв'язку - якими факторами вона визначається?
6. Яка речовина володіє найбільшою ступенем ионности?
7. Що таке металева зв'язок?
8. Які властивості металів пов'язані з металевим типом зв'язку?
9. Коли виникає воднева зв'язок? Як вона впливає на фізичні властивості речовин?
10. Від яких факторів залежить міцність і довжина зв'язку?
11. Сигма і пі зв'язку. Відмінності і характеристики.
12. Типи гібридизації орбіталей в органічних і неорганічних речовин. Форма молекул з різними типами гібридизації.
13. Типи кристалічних решіток. Характеристики решіток різного типу: міцність, фізичні властивості.
14. Донорно-акцепторная зв'язок - особливості освіти, речовини, в яких вона присутня.